阻断SARS-CoV-2感染的人源性单克隆抗体
新型人类冠状病毒SARS-CoV-2在中国武汉的出现,引起了呼吸系统疾病(冠状病毒)的世界性流行。目前缺乏治疗这种疾病的疫苗和靶向疗法。在此,我们报道了一种在细胞培养中中和SARS-CoV-2(和SARS-CoV)的人源性单克隆抗体。这种交叉中和抗体针对这些病毒上的一个公共表位,可能为预防和治疗冠状病毒提供潜在的机会。
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)是2019年末在中国出现的引起大流行的冠状病毒19(冠状病毒)的病原体。截至2020年4月19日,全球共报告2,241,778例,其中152,551例(6.8%)死于该感染2。SARS-CoV-2与SARS-CoV亚属(贝塔科冠状病毒,冠状病毒科)3同属1。SARS-CoV-2与SARS-CoV-2、SARS-CoV-2和SARS-CoV-2同属。这两种病毒都跨越了动物宿主的物种障碍,可能会导致人类患上一种危及生命的呼吸道疾病。目前,还没有获得批准的针对冠状病毒的靶向治疗药物。针对病毒表面蛋白脆弱部位的单克隆抗体越来越被认为是一类很有前途的抗感染性疾病的药物,并已对一些病毒4、5显示出治疗效果。
冠状病毒中和抗体主要针对病毒表面介导进入宿主细胞的三聚体尖峰(S)糖蛋白。S蛋白有两个功能亚基,介导细胞附着(S1亚基,存在四个核心区S1A到S1D)和病毒与细胞膜的融合(S2亚基)。有效的中和抗体通常针对S1的受体相互作用位点,使受体相互作用失效6、7、8、9、10、11。SARS-CoV-2(SARS2-S;1273个残基,武汉-Hu-1株)与SARS-CoV(SARS-S,1255个残基,Urbani株)的刺突蛋白一级氨基酸序列有77.5%的同源性,结构上非常相似,通常与人血管紧张素转换酶2(ACE2)蛋白结合为。已知受体相互作用可触发冠状病毒刺突蛋白的不可逆构象变化,从而实现膜融合17。
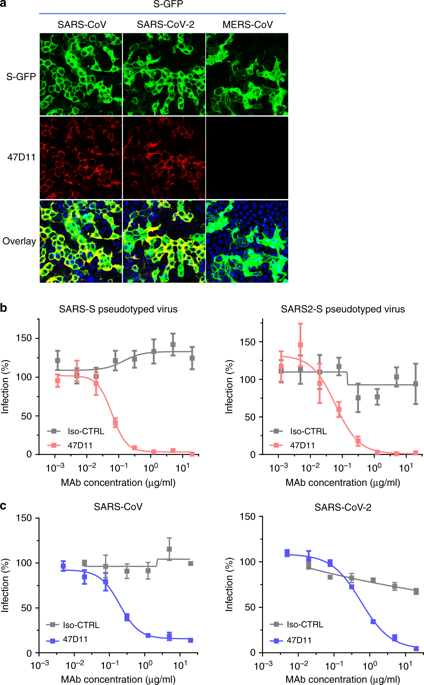
为了鉴定SARS-CoV-2中和抗体,对51株SARS-S杂交瘤的含有抗体的上清进行了ELISA交叉反应性检测,这些杂交瘤来自免疫的转基因H2L2小鼠,这些杂交瘤编码具有人可变重链和轻链以及恒定鼠源性区域的嵌合免疫球蛋白(补充表1)。51株SARS-S杂交瘤上清液中有4株与SARS2-S1亚基呈ELISA交叉反应(S残基1-681;补充表1),其中1株(47D11)表现出SARS-S和SARS2-S假型VSV感染的交叉中和活性。通过将人可变重链和轻链区克隆到人IgG1同型骨架上,将嵌合的47D11H2L2抗体重塑为完全的人免疫球蛋白。将重组表达的人47D11用于进一步的鉴定。
人47D11抗体与表达SARS-CoV和SARS-CoV-2全长刺突蛋白的细胞结合(图1a)。47D11抗体对SARS-S和SARS-S假型病毒感染VeroE6细胞有较强的抑制作用,IC50值分别为0.061和0.061 μg/ml(图1b),表明47D11抗体能有效地抑制SARS-S和SARS-S假型病毒对VeroE6细胞的感染,IC50值分别为0.061和0.061 mmol g/ml。用SARS-CoV和SARS-CoV-2感染VeroE6细胞,IC50值分别为0.19和0.5 7 μg/ml(图1c)。经ELISA检测,47D11具有针对SARS-S和SARS2-S的S1B受体结合域(RBD)的活性。47D11以相似的亲和力结合两种病毒的S1B,如ELISA法的半数最大有效浓度(EC50)值(分别为0.02和0.03 μg/ml;图2a)所示。尽管等摩尔抗原包被(补充图1),但基于ELISA的47D11与SARS-CoV-2尖峰外区(S Ecto)的结合亲和力高于SARS-CoV-2(EC50值分别为0.018和0.15 μg/ml)。与ELISA反应性一致的是,用生物层干涉法测定47D11的结合动力学表明,47D11与SARS-S ecto的亲和力(平衡解离常数[K D]:0.745 nM)高于SARS-S-S ecto(K D 10.8 nM),而与SARS-S1 B和SARS-S 1 B的亲和力相似(分别为16.1和9.6 nM,补充图2)。这种差异可能源于SARS-S和SARS2-S在表位可及性方面的差异,因为结构域B可以在预灌峰均三聚体12、13中采用封闭和开放的构象。值得注意的是,如流式细胞术所示,47D11与SARS-S1 B和SARS2-S1 B的结合并不与S1 B与细胞表面表达的ACE2受体的结合竞争(图2b;补充
总之,这是首次报道中和SARS-CoV-2的(人类)单克隆抗体。47D11结合一个保守的表位在尖峰RBD上,解释其交叉中和SARS-CoV和SARS-CoV-2的能力,使用一种独立于受体结合抑制的机制。该抗体可用于针对SARS-CoV-2的抗原检测试验和血清学检测。中和抗体可以改变感染宿主中支持病毒清除的感染过程,或保护暴露在病毒4中的未感染宿主。因此,这种抗体-无论是单独还是联合使用-提供了预防和/或治疗冠状病毒的潜力,也可能是未来由萨贝克病毒亚属病毒引起的人类新出现的疾病。
利用pCAGGS表达质粒,在HEK-293T细胞中瞬时表达了SARS-CoV-2(残基1-1213;武汉-Hu-1株;GenBank:QHD43416.1)和HCoV-OC43(残基15-1263;株Paris;UniProtKB:Q696P8)的冠状病毒尖峰外区(S Ecto)。类似地,如前所述产生编码SARS-CoV的S1或其亚域(S1,残基1-676;S1A,残基1-302;S1B,残基,325-533)和SARS-CoV-2(S1,残基1-682;S1A,残基1-294;S1B,残基329-538)C-末端标记的人或鼠IgG或链标签的pCAGGS表达载体。将MERS冠状病毒(残基19-1262;株EMc;基因库:YP_009047204.1)和SARS-CoV(残基15-1182;株Urbani;基因库:AY278741.1)与C端三聚基序、凝血酶裂解位点和链标签纯化标签进行框内融合,克隆到pMTBIPV5\His表达载体中。S1/S2连接处的糠蛋白裂解位点发生突变,以防止该位置的糠蛋白切割。如前所述,在果蝇S2细胞系中稳定地产生了穗状胞外域。用Protein-A琼脂糖珠(GE Healthcare,Catalog#17-0780-01)或Streptactin珠子(IBA,Catalog#2-1201-010)从培养上清液中亲和纯化重组蛋白。用考马斯亮蓝SDS-PAGE检测纯化的重组蛋白的纯度和完整性。
用纯化的HCoV-OC43、SARS-CoV、MERS-CoV、HCoV-OC43、SARS-CoV、MERS-CoV依次免疫H2L2小鼠,间隔2周。抗原以20-25 μg/只小鼠注射,使用根据制造商第一次注射说明新鲜制备的刺激性佐剂(Prionics),而增强则使用RIBI(SIGMA)佐剂。左、右腹股沟皮下注射各50 μl,腹腔注射10 0 μl。最后一次注射后4d,取脾脏和淋巴结,以SP2/0骨髓瘤细胞株(ATCC#CRL-1581)为融合伙伴,用标准方法制备杂交瘤细胞株。用抗原特异性ELISA法筛选杂交瘤细胞,筛选出可进一步发展的杂交瘤细胞株,并进行亚克隆和小规模生产(100 ml培养基)。为此,杂交瘤细胞在无血清和无蛋白培养基中培养杂交瘤细胞(PFHM-II(1×),Gibco),并添加非必需氨基酸100×NEAA,BioWhittaker Lonza,Catalog#BE13-114e。用蛋白-G亲和层析法从杂交瘤培养上清液中纯化H2L2抗体(Merck KGaA,目录号16-266)。纯化的抗体保存在4˚C中直到使用。动物研究是根据CCD(中央动物实验委员会)批准的动物许可证AVD101002016512进行的。
为了生产重组人mAb,将编码47D11H2L2mAb重链和轻链可变区的cDNA分别克隆到含有人IgG1重链和Ig kappa轻链恒定区的表达质粒中(InvivoGen)。两个质粒都含有白细胞介素-2信号序列,使重组抗体能够有效分泌。根据InvivoGenIgG1重链和轻链表达质粒对转染HEK-293T细胞,获得重组人47D11mAb和先前报道的同型对照(抗链球菌标记mAb)或7.7G6IgG1mAb。 重链和轻链表达质粒转染HEK-293T细胞后,可获得重组人47D11mAb和前述同型对照(抗链TagmAb)或IgG1mAb。用蛋白A亲和层析法从细胞培养上清液中纯化人源抗体。纯化的抗体保存在4˚C中直到使用。
免疫荧光显微镜检测与SARS-CoV、SARS-CoV-2和MERS-CoV细胞表面刺突蛋白结合的抗体。接种于玻片上的HEK-293T(ATCC#CRL-3216)用脂质体将编码SARS-S、SARS-S或MERS-S-C的质粒转染到绿色荧光蛋白上(Invitgen,目录号11668019)。转染2天后,用2%多聚甲醛在磷酸盐缓冲液中室温孵育20 m in,染色。
Nunc Maxisorp板(Thermo Science)在4°C下涂布等摩尔抗原量过夜。用含0.05%吐温-20的PBS清洗3次,然后在含0.1%Tween-20的PBS中用3%牛血清白蛋白(Bio-Connect)封闭,室温下持续2 小时。加入从10 µg/ml开始的4倍系列单抗(在阻断缓冲液中稀释),室温下孵育1 小时。用辣根过氧化物酶标记的羊抗人二抗(ITK Southern Biotech,ITK Southern Biotech)与1:2 0 0 0稀释的阻断缓冲液在室温下孵育1 h。一种HRP偶联的抗链单抗(IBA,Catalog#2)。
..