革命性的显微技术首次看到单个原子
一种被称为冷冻电子显微镜的改变游戏规则的分子成像技术已经产生了迄今为止最清晰的图像,并首次识别出蛋白质中的单个原子。
通过使用低温电子显微镜(Cryo-EM)实现原子分辨率,研究人员将能够以前所未有的细节了解蛋白质的工作原理,这些蛋白质的工作原理不容易用其他成像技术(如X射线结晶学)检查。
科学家说,上月底两个实验室报告的这项突破,巩固了冷冻EM作为绘制蛋白质3D形状的主导工具的地位。最终,这些结构将帮助研究人员了解蛋白质如何在健康和疾病中发挥作用,并导致副作用更少的更好的药物。
“这确实是一个里程碑,这一点是肯定的。真的没有什么可打破的了。这是最后一个分辨率障碍,“德国哥廷根马克斯·普朗克生物物理化学研究所(Max Planck Institute For BiPhysical Chemical)的生物化学家和电子显微镜专家霍尔格·斯塔克(Holger Stark)说,他领导了其中一项研究1。另外两项研究是由英国剑桥分子生物学医学研究委员会实验室(MRC-LMB)的结构生物学家Sjors Scheres和Radu Aricescu领导的。这两本书都于5月22日发布在BioRxiv预印本服务器上。
“真正的‘原子分辨率’是一个真正的里程碑,”加拿大多伦多大学的结构生物学家约翰·鲁宾斯坦补充道。获得许多蛋白质的原子分辨结构仍然是一项艰巨的任务,因为还有其他挑战,比如蛋白质的灵活性。他补充说:“这些预印本表明,如果那些其他限制能够得到解决,人们可以达到什么程度。”
低温电磁是一项有几十年历史的技术,它通过向闪速冻结的样品发射电子并记录产生的图像来确定它们的形状。探测反弹电子的技术和图像分析软件的进步催生了一场始于2013年左右的“分辨率革命”。这导致蛋白质结构比以往任何时候都更清晰-几乎与X射线结晶学获得的结构一样好,X射线结晶学是一种更古老的技术,当蛋白质晶体受到X射线轰击时,它会从蛋白质晶体的衍射图案中推断出结构。
随后的硬件和软件进步带来了低温电磁结构分辨率的更多改进。但科学家不得不在很大程度上依赖X射线晶体学来获得原子分辨率结构。然而,研究人员可以花几个月到几年的时间让蛋白质结晶,许多重要的医学蛋白质不会形成可用的晶体;相比之下,冷冻-EM只要求蛋白质在纯化的溶液中。
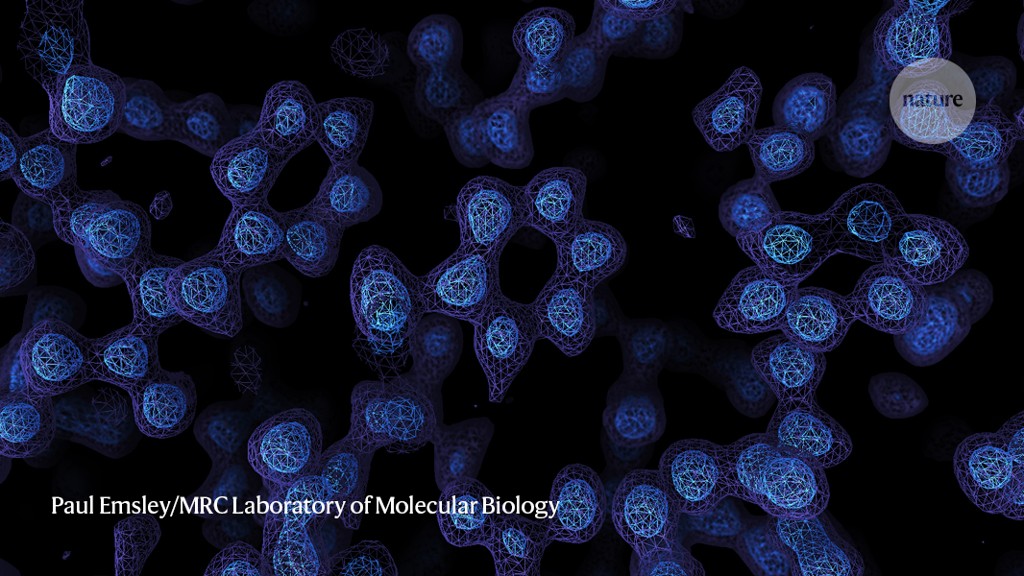
原子分辨率地图足够精确,可以清晰地分辨出蛋白质中单个原子的位置,分辨率约为1.2°ngströms(1.2×10-10米)。这些结构对于了解酶是如何工作的,以及利用这些洞察力来识别可以阻止其活性的药物特别有用。
为了推动冷冻-EM达到原子分辨率,两个团队致力于一种名为载铁蛋白的储铁蛋白质的研究。由于其岩石般的稳定性,这种蛋白质已经成为冷冻EM的试验台:这种蛋白质的分辨率为1.54ngströms的结构是之前的纪录3。
然后,研究小组使用技术改进来拍摄更清晰的脱铁蛋白照片。斯塔克的团队在一台仪器的帮助下,获得了这种蛋白质的1.25-ngström结构,这种仪器可以确保电子在击中样本之前以相似的速度移动,从而提高了结果图像的分辨率。Scheres、Aricescu和他们的团队使用了一种不同的技术来发射以相似速度移动的电子;他们还受益于一种技术,该技术可以减少一些电子在离开蛋白质样本后产生的噪音,以及一台更灵敏的电子探测相机。Scheres说,他们的1.2°ngström结构是如此完整,以至于他们可以分辨出蛋白质和周围水分子中的单个氢原子。
史塔克认为,融合这些技术可以将分辨率推到1ngström左右--但不会更远。他说:“低于1³几乎不可能拿到低温EM。”他的团队估计,用现有的尖端技术获得这样的结构将需要“几百年的数据记录和不切实际的计算能力和数据存储能力”。
Scheres和Aricescu还测试了他们在一种名为GABA A受体的简化蛋白质上的改进。这种蛋白质位于神经元的膜上,是全身麻醉剂、焦虑药物和许多其他药物的靶标。去年,Aricescu的团队使用冷冻EM将蛋白质映射到2.5?ngströms4。但使用新的试剂盒,研究人员获得了1.7?ngström的分辨率,在蛋白质的一些关键部分的分辨率甚至更高。Aricescu说:“这就像剥掉了你眼睛上的一层模糊的东西。”“在这个决议下,每半个ngström就打开了一个完整的宇宙。”
结构揭示了蛋白质中前所未见的细节-包括口袋里的水分子,那里有一种名为组胺的化学物质。“这是基于结构的药物设计的金矿,”Aricescu说,因为它展示了一种药物如何取代水分子,潜在地导致副作用较少的药物。
Scheres说,GABA A的原子分辨率地图不像载脂蛋白那样稳定,这将是一个挑战。“我不认为这是不可能的,但这将是非常不切实际的,”因为需要收集大量的数据。但其他方面的改进,特别是在蛋白质样品制备方面的改进,可能会为GABA A和其他生物医学上重要的蛋白质的原子分辨结构铺平道路。蛋白质溶液被冻结在由黄金制成的微小格子上,对这些格子的改变甚至可以容纳蛋白质,甚至是斯蒂勒5号(Stiller 5)。
东京大学(University Of Tokyo)低温电磁专家拉多斯丁·丹尼夫(Radostin Danev)表示:“每个人都对MRC-LMB和马克斯·普朗克(Max Planck)组合所展示的真正令人震惊的表现感到非常兴奋和惊讶。”但他同意,对于更不稳定的蛋白质来说,样品制备是该领域的主要挑战。他说:“在一段时间内,只有表现良好的样本才能获得亚1.5奥甚至亚2奥级的分辨率性能。”
Scheres说,这些突破可能会巩固Cryo-EM作为大多数结构研究首选工具的地位。垂涎原子分辨结构的制药公司可能更有可能转向低温EM。但斯塔克认为X射线结晶学将保留一些吸引力。如果一种蛋白质可以结晶--这是一个很大的问题--在短时间内产生与数千种潜在药物结合的结构是相对有效的。但是,为极高分辨率的低温电磁结构生成足够的数据仍然需要几个小时到几天的时间。
斯塔克说:“每种技术都有优缺点。”“人们发表了很多论文和评论,说低温电磁波的这些最新进展将是X射线的死亡信号。我对此表示怀疑。“