重症新冠肺炎患者具有独特的表型
冠状病毒病2019年(新冠肺炎)的特点是疾病进展模式不同,提示宿主免疫反应多样化。我们对50例不同疾病严重程度的新冠肺炎患者进行了综合免疫分析。在重症和危重患者中观察到一种独特的表型,包括高度受损的干扰素I型应答(特征是没有干扰素-β和低干扰素-α的产生和活性),并与持续的血液病毒载量和加重的炎症反应相关。炎症部分由转录因子NF-κB驱动,其特征是肿瘤坏死因子-α和白细胞介素-6的产生和信号增加。这些数据表明,血液中I型干扰素缺乏症可能是严重新冠肺炎的一个标志,并为联合治疗提供了理论基础。
2019年底首例SARS-CoV-2冠状病毒病(新冠肺炎)病例的早期临床描述迅速突显了鲜明的疾病进展模式(1)。虽然大多数患者经历轻到中度的疾病,但5-10%的患者进展为严重或危重疾病,包括肺炎和急性呼吸衰竭(2,3)。根据来自中国大陆的经实验室确认的新冠肺炎患者的数据,6.1%的患者住进重症监护病房、有创机械通气或死亡(1),根据法国最新数据计算的死亡率为0.70%(3)。这一危重病例的比例高于季节性流感的估计(4例)。此外,据报道,50岁及以下的年轻人(50岁及以下)呼吸衰竭的发生率相对较高,他们以前有轻度并存(如高血压、糖尿病、超重)(5)。严重病例可能发生在病程早期,但临床观察通常描述了两个阶段的疾病进展,首先是轻到中度的症状,然后是第一次出现症状后9-12天的继发性呼吸恶化(2、6、7)。呼吸恶化伴随着胸部CT扫描磨玻璃样肺阴影的扩大、淋巴细胞减少、凝血酶原时间和D-二聚体水平升高[2]。这种以血液中急性期反应物急剧增加为特征的双相演变表明,炎症宿主反应失调,导致促炎和抗炎介质之间的失衡。这导致随后白细胞在导致急性呼吸窘迫综合征(ARDS)的组织中的募集和积累(8)。然而,关于新冠肺炎严重程度的免疫学特征和分子机制尚不清楚。
为了验证病毒驱动的高炎症导致严重疾病的假说,我们采用了基于临床和生物学数据的综合方法,深入的免疫细胞表型分析,标准化的全血转录分析和细胞因子测定对5 0例新冠肺炎患者进行了从轻度到危重的不同程度的检测。
新冠肺炎患者(n=50)和健康对照组(n=18)。补充材料中详细描述了患者的特征,表S1和图中对其进行了描述。S1.。患者在发病后平均持续10天(四分位数范围,9-11天)后进行分析。入院时,新冠肺炎的严重程度分为轻至中度(n=15例)、重度(n=17例)和危重(n=18例)。
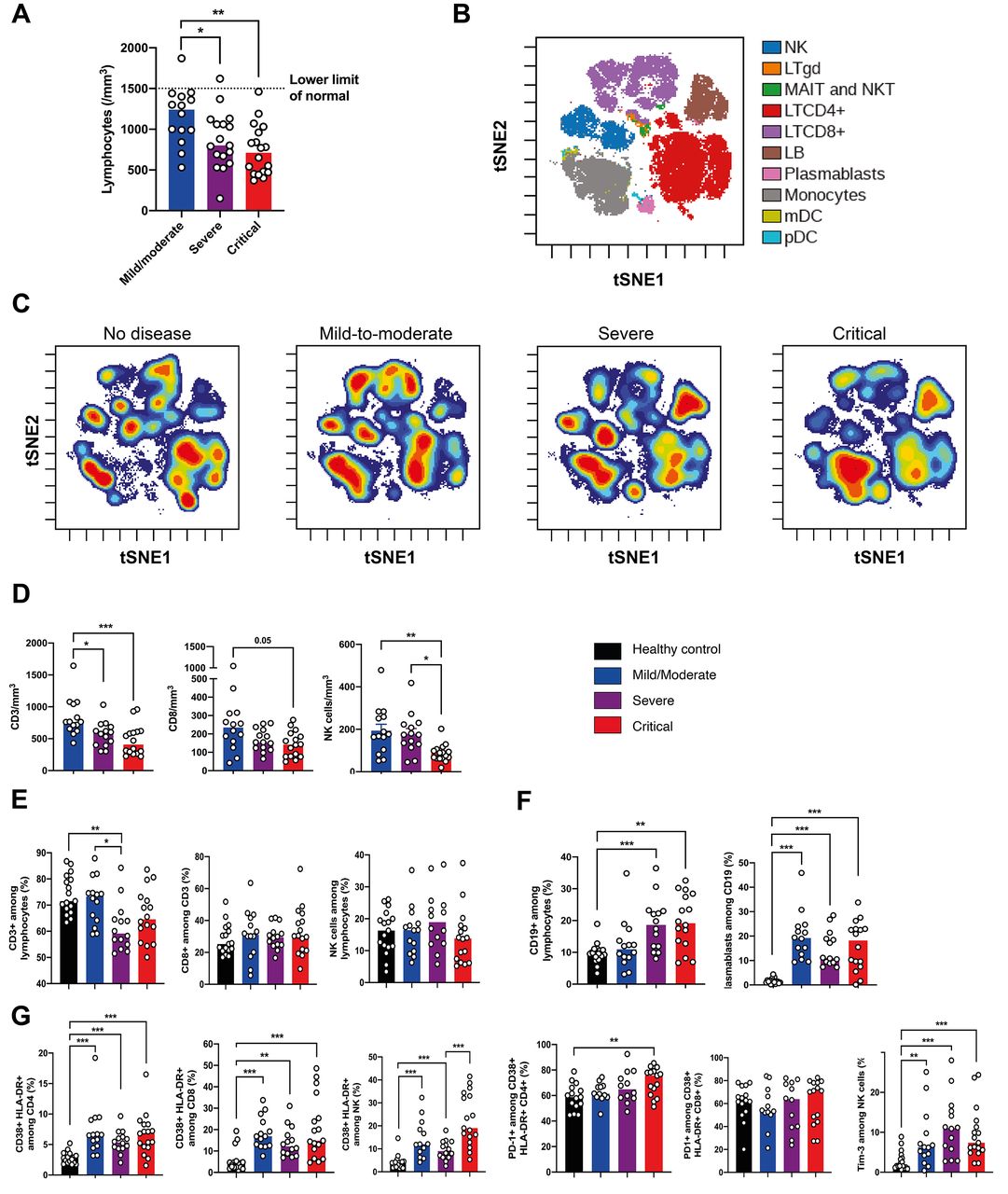
正如以前的研究(1,2,8)所报道的那样,淋巴细胞减少与疾病的严重程度相关(图1A)。为了进一步表征这一点,我们使用了质量细胞术,并进行了t分布随机邻居嵌入(ViSNE)(9)的可视化,以根据疾病的严重程度比较细胞群体密度(图1B)。VSNE表达和分化细胞计数显示NK细胞和CD3+T细胞(包括所有T细胞亚群)密度下降,CD8+T细胞下降更为明显。与B细胞和单核细胞密度增加形成对比的是,这种表型在重症和危重患者中更为突出(图1,C至F)。没有观察到CD4+和CD8+T细胞幼稚/记忆亚群的主要失衡(图3)。(S2)。图3中示出了关于T细胞极化和其他次要T细胞子集的数据。S3.。所有感染患者的浆母细胞都被富集(图1F),与B细胞激活和浆母细胞分化相关的基因,如IL4R,TNFSF13B和XBP1(图1F)的增加支持了这一点。S4),但没有明显增加血清免疫球蛋白水平(图4)。中五)。
然后,我们使用激活(CD25,CD38,HLA-DR)和耗竭(PD-1,TIM-3)的标记物来评估特定T细胞亚群和NK细胞的功能状态(图1,TIM-3)。S6A)。CD4+和CD8+T细胞亚群的特点是CD38+HLA-DR+活化的T细胞在所有感染性疾病中均有增加。
据报道,重度新冠肺炎伴有高细胞分裂素血症(8例,16例)。研究队列中发现细胞因子和趋化因子相关基因作为疾病严重程度的函数越来越多地表达(图4A和图4)。S9A)。有趣的是,细胞因子全血RNA水平并不总是与血浆蛋白水平相关。IL-6,新冠肺炎(17)中炎症反应加剧的关键分子,在转录水平上没有在外周血液中检测到(图3)。S9B),与高水平的IL-6蛋白形成对比(图4B)。IL-6诱导的IL-6R、SOCS3和STAT3基因表达显著增加(图3)。S9B)反映了IL-6信号通路的激活。肿瘤坏死因子-α,炎症的关键驱动因素,仅在转录水平适度上调(图3。S9C),而循环肿瘤坏死因子-α显著增加(图4C)。相应地,TNF途径相关基因也上调,包括TNFSF10(图3)。S9、D和E),支持肿瘤坏死因子-α在诱导炎症中的重要作用。α和IL-6的细胞来源可能是受损的肺和(或)内皮细胞,其定量结果与蛋白质测定结果的差异提示,TNF-mRNA和IL-6的细胞来源可能是受损的肺和/或内皮细胞。相反,当IL1B转录本显著上调时(图3)。S9F),IL-1β蛋白的活性形式很低(图4D),这表明前-IL-1β的切割和分泌很差,但不排除在肺中的局部产生(15)。也没有检测到循环中的IL-1α(图3)。S9F)。这些发现与检测到高水平的循环IL-1受体拮抗剂(IL-1RA)和IL-1R1转录本上调相比,表明IL-1在危重病患者中具有积极的拮抗作用(图3)。S9F)。我们还检测了重症或危重患者的IL-10转录本和IL-10蛋白(图4E和图4E)。S9G)。干扰素-γ在轻中度患者中升高,在重症患者中升高幅度较小,但在危重患者中不升高。相反,在所有感染患者组中均未检测到IL-17A水平的增加(图3)。S10)。
接下来,我们探索了可能导致炎症加剧的转录因子的表达,发现在重症或危重患者中特异性上调的基因主要属于NF-κB途径(图4F和图4F)。S11、A和B)。在几种触发途径中,NF-κB的异常激活可能是由病原体相关分子模式(如病毒核糖核酸)和/或损伤相关分子模式(如坏死细胞和组织损伤释放的)过度激活的先天免疫感受器引起的。有趣的是,LDH,一个坏死和细胞损伤的标志,与疾病的严重程度相关。受体相互作用蛋白激酶3,一种参与程序性坏死和炎性细胞死亡的关键激酶,在重症或危重患者中也显著升高(图4G),并与乳酸脱氢酶相关(R2=0.4 7;P<;0.0001)。
炎症反应的加剧与先天免疫细胞(即中性粒细胞和单核细胞)的大量涌入有关,这可能会加重肺损伤并导致ARDS(15)。因此,我们分析了参与先天免疫细胞运输的趋化因子和趋化因子受体的表达(图4A)。血清中检测到中性粒细胞趋化因子CXCL2,但组间无差异,其受体CXCR2在危重患者显著上调(图4H)。通常情况下,严重疾病伴有较高的中性粒细胞数(图4H)。值得注意的是,即使在中性粒细胞计数的转录数据正常化之后,炎症反应模式仍然升高。S12)。感染患者血液中单核细胞趋化因子CCL2及其受体CCR2的转录本增加,这与循环中炎性单核细胞计数减少有关(图4I),表明CCL2/CCR2轴在单核细胞趋化作用进入炎症肺中起作用。这些观察结果与已发表的新冠肺炎患者支气管肺泡液研究一致,这些研究描述了单核细胞的关键作用(15)。总体而言,这些结果支持这样一个框架,即在I型干扰素产生受损和病毒载量高的情况下,PAMPs和DAMPS都可能助长持续的炎症级联反应。
在这项研究中,我们在重症和危重新冠肺炎患者中发现了I型干扰素应答受损,并伴有高血病毒载量和过度的NF-κB驱动的炎症反应,并伴随着TNF-α和IL-6的升高。先天免疫传感器,如TLR和RIG-I样受体,通过感知病毒复制和通过表达一组不同的抗病毒基因来提醒免疫系统,在控制RNA病毒方面发挥着关键作用(18)。因此,包括干扰素-α,β和ω在内的I型干扰素被迅速诱导和编排成一个协调的
https://creativecommons.org/licenses/by/4.0/这是一篇开放获取的文章,根据知识共享署名许可证的条款分发,该许可证允许在任何介质上不受限制地使用、分发和复制,只要正确引用了原始作品。
致谢:我们感谢所有参与科钦医院患者诊断和治疗的医护人员,特别是C.Azoulay L.Beaudeau、E.Canoui、P.Cohen、A.Contejean、B.Dunogué、D.Journois、P.Legendre、J.Marey和A.Régent。我们感谢Y.Gaudin就病毒机制提出的建议。我们感谢所有的患者、支持者和我们的家人对我们工作的信心。资助:这项研究得到了免疫病理学创新基金会的支持。这项研究还得到了国家圣徒和医学研究院(INSERM)和巴斯德研究所的支持,政府赠款由国家研究院管理,是“未来投资”计划(ANR-10-IAHU-01和卓越实验室‘Milieu Intérieur“)的一部分,赠款编号。该基金由以下机构提供:ANR-10-LABX-69-01)、国家复兴开发协会(ANR-FLASH Covid19“AIROCovid”给FRL和“CoVarImm”给DD)以及FAST基金会(Sheba TelHashmer医院的法国朋友)。J.H.是IMAGINE医学博士研究院奖学金的获得者。
.