新的3D脱色技术使完整生物体的高分辨率成像成为可能
组织清除结合深度成像已成为经典组织学技术的有力替代。虽然目前的技术已经对选定的非色素器官(如哺乳动物的大脑)进行了成像优化,但对于大多数其他更大体积的生物样本来说,自然色素沉积仍然具有挑战性。我们开发了一种快速脱色-加-清除方法(Deep-Clearing),该方法易于整合到现有的工作流程中,并将整个系统标记与一系列检测技术相结合,从免疫组织化学到RNA原位杂交,增殖细胞的标记(EDU标记)和转基因标记的可视化。通过对整个动物的光片成像和对着色器官的详细共聚焦研究,我们对从蠕虫和鱿鱼到轴突和斑马鱼等动物模型的眼睛、整个神经系统和亚细胞结构提供了前所未有的洞察力。因此,深度清晰度为探索物种丰富的分支和发育阶段铺平了道路,这些阶段在很大程度上是常规成像方法无法接近的。
在过去的几十年里,对少数久负盛名的“分子模式物种”的关注有助于推动生物发现和技术发展。然而,越来越多的人认识到,这些模式物种只覆盖有限的生态多样性范围,需要在建立新的模式系统方面做出更系统的努力(1-4)。在建立多功能技术方面的进展是这一努力的关键。RNA测序技术的进步或精确基因组编辑方法的出现就是例证,这些工具已经开始为非常规模型的系统研究铺平道路(5-12)。
与测序或基因组编辑技术相比,其他方法在适用性和使用方面仍然受到更多限制,导致对较不成熟的生物学模型的探索受到很大限制。一个关键领域是细胞或分子在其自然组织环境中的成像,以及完整组织和有机体的成像。这通常涉及切片和重建,这是一个资源密集型的过程,在类似神经系统的情况下尤其具有挑战性,在这些情况下,被解剖的神经和单个神经元投射是出了名的难以重建。虽然先进的显微镜装置在薄样品中提供了卓越的分辨率,但神经系统、其他组织或整个生物体的深度成像因此在少数几个成熟的模型系统之外仍然是一个关键的挑战。主要原因是生物分子的折射率(RIS)差异(例如,水、脂肪和蛋白质)造成的光散射,以及天然色素对光的吸收(13)。
在哺乳动物大脑研究的推动下,已经建立了各种方法来解决无色素样品中RIS的异质性。这包括从富含脂质的组织(如中枢神经系统)中去除脂质,以及使用能够匹配RIS的培养基。匹配RI和/或去除脂质的策略已大致分为两类:主要依赖有机溶剂的策略,例如苯甲醇与苯甲酸苄酯(BABB)(14)、溶剂清除器官的三维成像(3DISCO)和启用免疫标记的溶剂清除器官的三维成像(IDISCO)(15-17)、终极DISCO(UDISCO)(18)、稳定的DISCO(SDISCO)(19),聚乙二醇(PEG)伴生溶剂系统(PEGASOS)(20)或第二代肉桂酸乙酯清洗剂(2ECi)(21);以及那些主要依赖于亲水性试剂和洗涤剂的方法,包括ClearT(22)、基于三乙醇胺和甲酰胺的快速清除方法(RTF)(23)、透明、通畅的脑成像鸡尾酒和计算分析(立方体)(24-27)、Scale(28,29)或SeeDB(30,31)方法,以及透明脂质交换的解剖刚性成像/免疫染色相容组织水凝胶(Clarity)(CLARITY)(32,33)方法的变体。
虽然这些技术中的每一种都提供了独特的优势,但它们并不容易适用于许多具有生态或进化兴趣的物种,这些物种表现出色素沉着。虽然现有的几种清除方案会使血红素(血色素)脱色,但它们并没有针对去除其他身体色素进行优化。动物通过保守的生化途径产生各种额外的色素。这些色素中有几种具有溶解性差的特点:黑色素是一种酪氨酸衍生的紫外线保护剂,在脂类和水基溶剂中都很难溶解[参见(35)],但它是脊椎动物视网膜色素上皮(RPE)的一种突出的色素,RPE是一层细胞,起到减轻光氧化应激和脱水的作用。
2)夏威夷短尾鱿鱼Euprymna Scolope和长鳍近岸鱿鱼Doryteuthis pealeii,两种头足类软体动物(孵化期,长3 mm)。
3)斑马鱼Danio rerio是硬骨鱼的代表(从幼鱼到幼鱼,长约12毫米)。
4)四足类(幼体标本,长达35 mm)的参考种--墨西哥紫杉(Axolotl Ambystoma Micianum)。
环节动物和软体动物都是大型轮虫纲的关键类群,而硬骨鱼和四足类是后口动物中物种最丰富的类群。因此,我们选择的模型涵盖了大量与生态相关的非昆虫动物多样性。此外,选定的物种和发育阶段还提供了获得感兴趣的神经生物学方面(如中枢神经系统再生、颅神经复杂性或不同类型的视觉器官)的典型途径,这些方面强烈受益于提供脱色素、清除、主动标记和全身成像的方法。
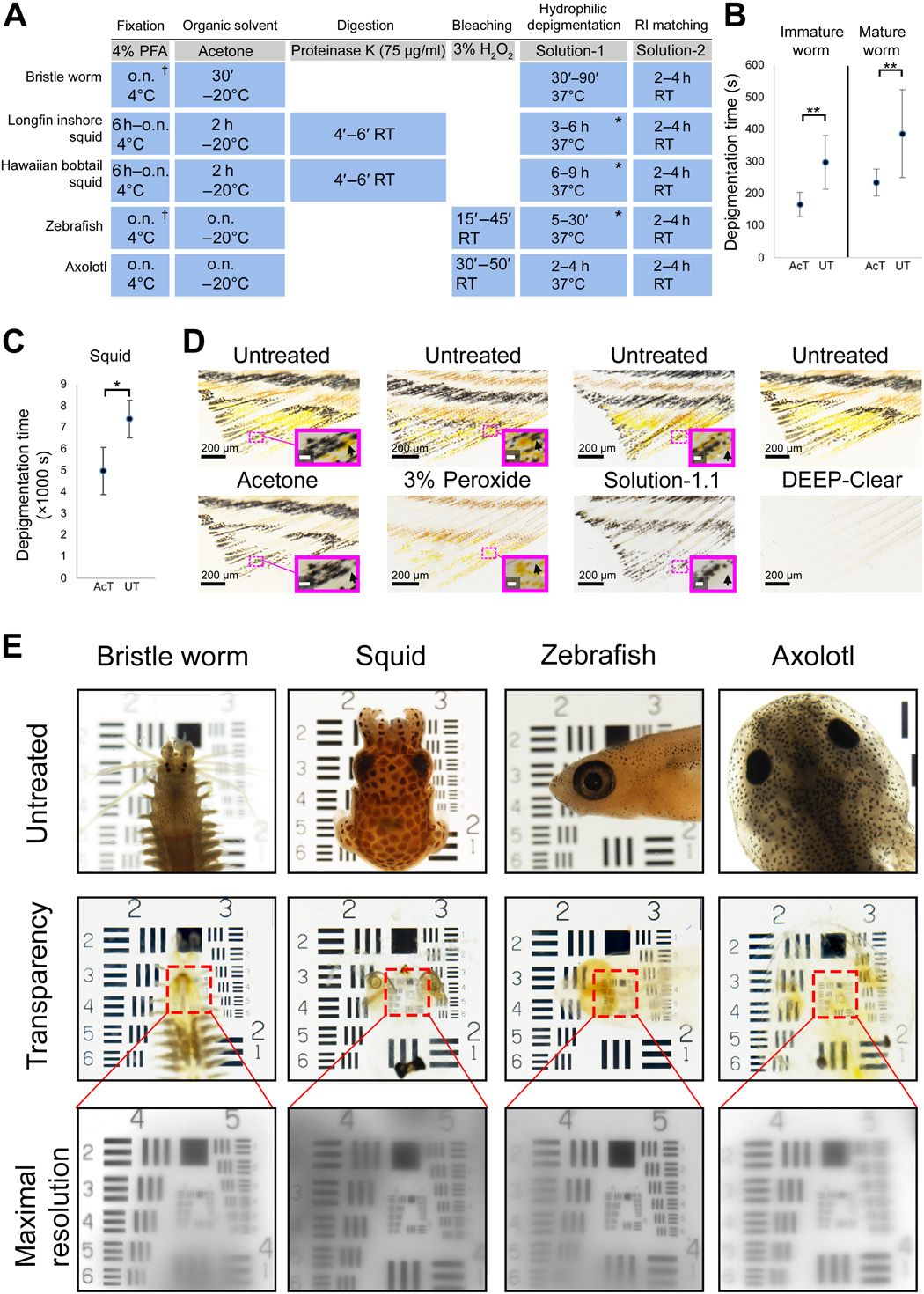
在一系列系统的实验中,我们逐渐修改了FlyClear协议和化学,以实现所有这些物种中不同种类的色素的脱色和组织的透明,从而产生了适用于每个研究样本的修订的深透明协议(图1A)。这一过程中的关键步骤是(I)FlyClear‘s Solution-1,这是一种基于超水化的溶液,含有氨基醇N,N,N’,N‘-四(2-羟乙基)乙二胺(THEED)、洗涤剂(Triton X-100)和尿素与丙酮(一种有机溶剂)相结合,从而加快了脱色速度,从而减少了长时间暴露可能造成的损害;(Ii)增加了含有黑色素的过氧化物漂白步骤。总而言之,每个样本的所有固定后清理步骤都可以在24小时或更短时间内完成(图1A),这使得深度清理易于合并到现有的工作流程中。如图1(B和C)所示,在两个测试的无脊椎动物模型中,有机溶剂步骤的应用大大减少了脱色时间,并在色素去除方面具有协同效应(图1D),使我们能够为每个物种生成脱色的透明样本(图1E)。
对于不同的色素类型,环节动物的深度透明处理使先前已被表征为含有蝶呤的成年眼睛脱色(图3)。S1a)(40),以及身体红色素中的额外红色素(图1)。S1、A和B)和以血红素为基础的血色素(图3)。S1B)(41)。我们注意到,这种处理也降低了蠕虫肠道中食用的菠菜的叶绿素(图4)。S1C)。此外,深透明去除了鱿鱼中基于全色素的色素(图3)。S1D)。如斑马鱼鳍所示(图1D),仅在室温下用丙酮处理会导致携带翼状化合物和类胡萝卜素色素的黄色素脱色,但不能去除黑色素团中存在的特征性黑色素(图1D)。此外,被分析的脊椎动物眼睛和身体组织中的黑色素即使在pH(13)升高和孵育时间延长的情况下,也不能通过单独使用Solution-1来完全溶解。在紫杉醇的眼睛和身体组织中,黑色素只是减少了(图3)。S1E),而在斑马鱼中,这种延长的溶液-1处理会导致严重的组织损伤,需要在随后的斑马鱼实验中改用尿素减少的溶液-1.1。溶解黑色素的困难是目前清除方法(13,27)的一个已知缺点,并促使我们加入3%过氧化氢的预处理步骤,以实现含黑色素样品的完全脱色(图1A)。单独用过氧化氢预处理能有效地漂白黑色素,但不能漂白斑马鱼鳍中蝶呤和类胡萝卜素的黄色素(图1D),也减少了Axolotl眼睛中的色素沉着(图1D)。S1F)。相比之下,将这种过氧化物处理与已建立的丙酮和Solution-1(.1)处理以及适当的RI匹配相结合,保留了样本形态,并产生了1951年美国空军分辨率测试图(USAF图)上评估的最高水平的组织透明度(图1E和图8)。S1G)。由于来自转基因荧光团的过氧化氢损伤信号的使用,重新标记这些荧光团的策略将在后面的章节中提出。对于RI配型,我们使用了含有泛影葡胺的溶液-2;对于更大的样本,包括富含脂质的组织,通过补充N‘-甲基烟酰胺和安替比林(称为溶液-2.2)对该溶液进行了进一步修改,这与已发表的在不导致组织变形的情况下提高RI的策略是一致的(27)。
总而言之,这些结果确立了
虽然延长丙酮处理被认为是变性荧光蛋白,我们注意到丙酮处理的转基因斑马鱼和小鼠(图。S3,A到C)保留了它们各自的荧光蛋白荧光:我们通过比较未经处理的样品与在−20°C下暴露于丙酮的样品对Brn3c::mGFP和Huc::Gal4;UAS::SYP-GFP斑马鱼和Thy1-YFP-H小鼠的荧光信号强度产量的影响,检测到相似或略有降低的荧光信号强度(图3)。S3,A到C)。在深度透明处理的PMOS{Rops::EGFP}vbci2成虫(图2A)中,我们可以看到增强型GFP阳性(EGFP+)眼光感受器细胞的投影路径(图2B)。同样,对完全蠕虫的光片显微镜能够分辨胞体和外周EGFP+细胞从单个附足到主干腹神经索纤维上并沿着主干腹神经索的纤维的单个投射(图2,C和D)(42)。由于信号稳定性对于成像和样本存档都是一个相关的方面,我们也使用经过深度清除处理的蠕虫样本来评估EGFP信号是否能够长期有效地保存。这些分析表明,即使在几周后,EGFP+结构也可以明显地与自体荧光区分开来,与记录的第一天相比,仅表现出有限的衰减(图5)。S4,A到D)。虽然色素沉着在分析哺乳动物的大脑样本中没有相关的挑战,但我们使用了Thy1-YFP-H转基因小鼠大脑的半球来评估大样本的成像。在这个实验中,深清晰度处理允许跨越近6,000μm深度的荧光细胞体成像,与建立的立方体方法(图3)相当。S5、A至E)(26)。为了研究在黑化样品处理的背景下使用过氧化物是否与信号重新标记兼容,我们对不同发育阶段[受精后6、10、17和23天(DPF)]的深透明处理的brn3c::mGFP斑马鱼样品进行了抗GFP染色。S6、A至D]。抗GFP免疫组织化学使我们能够看到视网膜神经节细胞到视顶盖的特征性投射(图3)。S6、B至D)(43)。为了解决如果在深透明过程中包括过氧化物处理步骤是否会保留更精细的亚细胞结构,我们使用了表达突触前小泡标记synaptophysin(44)的GFP融合蛋白的Huc::Gal4;UAS::SYP-GFP样本。与先前关于该标记在顶盖发育过程中神经元树枝的存在的工作一致(44,45),我们的分析显示在3DPF幼虫的顶盖中有一个致密的网状点状结构(图2)。S6E)。在后脑中部和邻近的小脑也发现了类似的点状突起(图3)。S6F)。
由于内源性表达的荧光团仅限于更成熟的实验室模型,我们进行了一系列额外的实验,以评估Deep-Clear是否也与各种免疫组织化学标记的表位兼容。我们将大部分分析集中在各自物种的神经系统上,因为神经系统的复杂性对经典的基于切片的标记工作提出了特别的挑战,因为延伸到不同切片上的神经投影很难重建。此外,神经系统对于进化和比较分析具有特殊的相关性。
为了探索Deep-Clear与IHC分析的兼容性,我们利用了识别保守或特定表位的抗体。在所有物种中,我们使用了一种针对乙酰化α-微管蛋白的单克隆抗体,该抗体已被广泛用于可视化动物神经系统(46-51)。在Axolotl中,我们还使用了针对神经元特异性βIII微管蛋白亚型(TUBB3)的TuJ1抗体(52-54)。我们通过针对更具特异性表达的表位进行免疫组织化学来补充这些全面的神经解剖学分析。当需要时,我们使用一种改良的RI匹配溶液(Solution-2.1),其中我们包括四份Solution-2和一份VECTASHIELD,或者将样品嵌入到纯VECTASHIELD中,以防止荧光团漂白。为了分析整体神经解剖学,我们使用光片显微镜,用共聚焦分析来补充这些分析,以研究细胞或亚细胞的细节。
在用抗乙酰化微管蛋白抗体免疫染色的溶液-1处理的成虫标本中,光片显微镜显示中枢神经系统的头部和非头部部分以及环节动物周围神经系统的诊断节段神经均有标记(图2e和电影S1和S2)(55)。仔细观察头部区域,可以获得对大脑结构的详细洞察和成人眼杯的高分辨率视图(图2F)。我们用激光共聚焦显微镜对完全头进行显微观察,获得了眼部的精细结构。