Neuropilin-1促进SARS-CoV-2细胞进入和感染性
2019年(新冠肺炎)冠状病毒诱发疾病的病原体是严重急性呼吸综合征冠状病毒2(SARS-CoV-2)。对许多病毒来说,组织嗜性是由宿主细胞表面病毒受体和进入辅因子的可用性决定的。在这里,我们发现神经菌素-1(Nrp1),已知可以结合Furin裂解的底物,显著增强SARS-CoV-2的传染性,这种作用被针对Nrp1的单克隆阻断抗体所阻断。具有改变的呋喃裂解位点的SARS-CoV-2突变体不依赖于Nrp1的传染性。对新冠肺炎尸检标本进行病理分析,发现感染SARS-CoV2的细胞包括面向鼻腔的嗅神经细胞,Nrp1呈阳性。我们的数据提供了对SARS-CoV-2细胞感染性的洞察力,并确定了抗病毒干预的潜在靶点。
SARS-CoV-2感染的爆发导致了与一种名为新冠肺炎(冠状病毒诱导的疾病2019年)(1)的严重急性肺部疾病相关的大流行。一种相关的冠状病毒SARS-CoV在2003年导致的疫情要小得多,可能是由于感染主要发生在下呼吸道系统,而SARS-CoV-2通过活跃的咽部病毒脱落迅速传播(2)。尽管存在这些差异,但这两种病毒的吸收是由相同的细胞受体-血管紧张素转换酶2(ACE2)(3-5)介导的。解释SARS-CoV-2增强传播的一个有吸引力的假设是,在SARS-CoV-2刺突(S)蛋白的S1/S2连接处存在一个多碱的Furin型裂解位点RRAR^S,这在SARS-CoV中是不存在的(6)。在许多其他致病性人类病毒的S蛋白中也发现了类似的序列,包括埃博拉病毒、HIV-1和高毒力禽流感毒株(6,7)。SARS-CoV-2中多碱基裂解位点的存在通过启动融合活性而导致致病性增强(8),并可能潜在地产生额外的细胞表面受体结合位点。FURIN对RRAR^S的蛋白水解暴露了S蛋白中一个保守的羧端(C-端)基序RXXR OH(其中R是精氨酸,X是任何氨基酸;R可以被赖氨酸,K取代)。已知符合“C-末端规则”(CEDR)的这种C-末端序列结合并激活细胞表面(9)上的神经粘连蛋白(Nrp1和NRP2)受体。最近SARS-CoV-2S蛋白的冷冻电子显微镜结构表明,S1/S2连接是暴露在溶剂中的环的一部分,因此可以与受体相互作用(10,11)。
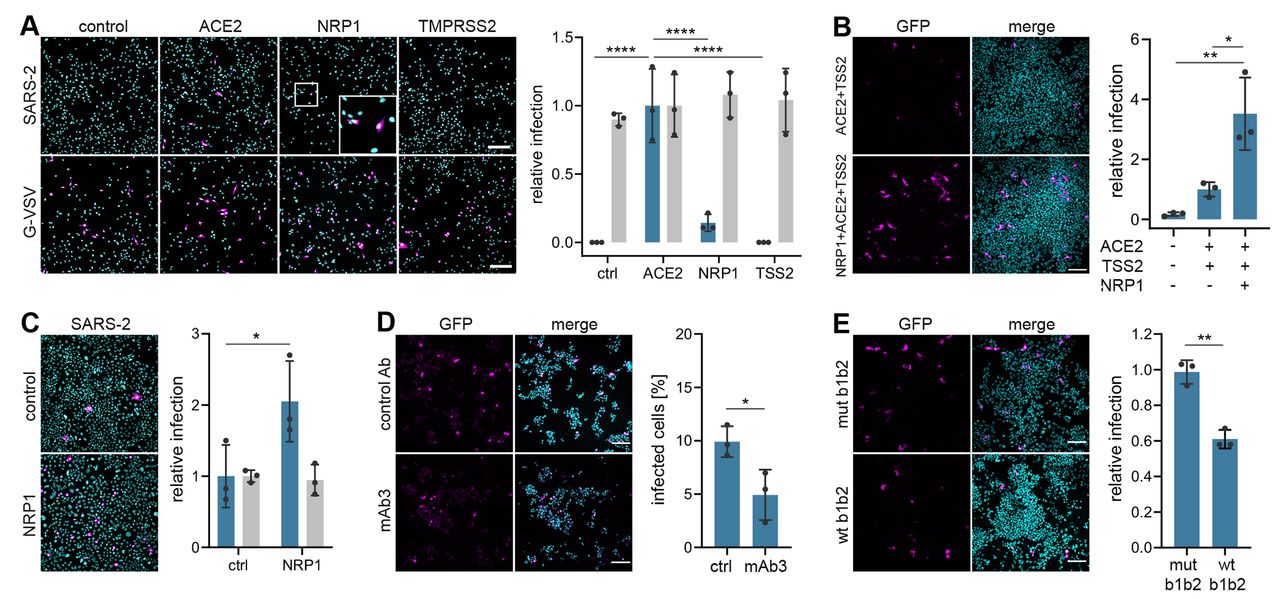
为了确定SARS-CoV-2是否可以利用Nrp1进行病毒侵入和传染性,我们用SARS-CoV-2S蛋白制备了假型慢病毒颗粒。伪病毒非常适合病毒进入试验,因为它们允许病毒进入与其他病毒生命周期步骤区分开来。HEK-293T细胞,几乎没有可检测到的ACE2和Nrp1转录本(图3)。将编码两个已建立的宿主因子(4)的质粒(人ACE2和跨膜蛋白酶丝氨酸2(TMPRSS2)或Nrp1)转染到大肠杆菌中。当ACE2单独表达时,使细胞容易感染(图1A)。虽然Nrp1在HEK-293T细胞中几乎不能促进感染,但它与ACE2和TMPRSS2的共表达显著促进了感染(图1,A和B)。Nrp1的表达增加了Caco-2细胞的感染,Caco-2细胞内源性表达ACE2(12)(图1C和图1C)。S1d),表明Nrp1在其他寄主因子存在的情况下可以增强感染。为了测试Nrp1依赖的病毒进入的特异性,我们开发了单克隆抗体(MAb),这些单克隆抗体被设计成功能性地阻断Nrp1的B1B2结构域,已知的是介导与cendR肽的结合(13)。观察到mAb3与野生型Nrp1的重组B1B2结构域结合,但不与三个突变体B1B2结构域(CENDR结合口袋中的S346A、E348A和T349A)结合(图2)。(S2A)。用80 nm银纳米颗粒(AgNP)包被Nrp1结合的cendR肽原型RPARPAR OH(9),检测mAb防止NRP配体与细胞结合和内化的效力(图4)。(S2B)。MAb3有效地阻断了AgNP-cendr结合(图2)。S2C)和内部化(图2)。S2、D和E),而另一种单克隆抗体mAb2无效,并在进一步的实验中用作对照。用mAb3处理HEK-293T可显著减少SARS-CoV-2伪病毒在表达ACE2/TMPRSS2/Nrp1的细胞中的感染(图1D),但不能仅在表达ACE2/TMPRSS2的细胞中感染(图1D)。S2F)。当SARS-CoV-2假病毒与Nrp1的重组可溶胞外B1B2结构域预先孵育时,与三重突变体相比,野生型显著减少了感染(图1E和图1E)。S2G)。
接下来,我们利用从赫尔辛基大学医院新冠肺炎患者中分离的SARS-CoV-2病毒来探讨Nrp1的作用。我们使用了野生型SARS-CoV-2和一个裂解受损的SARS-CoV-2突变体,该突变体是从
关于决定SARS-CoV-2进入细胞的病毒-宿主相互作用的知识有限。病毒表现出相当大的冗余性和灵活性,因为它们可以利用弱的多价相互作用来增强亲和力。虽然到目前为止,焦点几乎完全集中在ACE2在SARS-CoV-2进入中的作用上,但ACE2的表达模式与SARS-CoV-2的组织趋向性并不匹配(21)。这增加了在低ACE2表达的细胞中需要辅助因子来促进病毒与宿主细胞相互作用的可能性。Nrp1可以代表这样的ACE2增强因子;然而,当病毒载量较高时,SARS-CoV-2也有可能独立于ACE2进入细胞。许多病毒(22-25)使用NRP作为进入因子的原因可能是因为它们在面对外部环境的上皮细胞上的高表达,以及它们能够使细胞、血管和组织穿透的功能(9,13)。
Https://creativecommons.org/licenses/by/4.0/这是一篇开放获取的文章,根据知识共享署名许可证的条款分发,该许可证允许在任何介质上不受限制地使用、分发和复制,只要正确引用了原始作品。
致谢:我们感谢勒内·穆勒(RenéMüller)、卡佳·舒尔茨(Katja Schulz)和Uta Scheidt提供的专家技术援助。肖娜·奥斯本(Shona Osborne)用于校对手稿,DNA Dream Lab设备和康斯坦丁·科根(Konstantin Kogan)用于设计和克隆质粒。资金:慕尼黑和哥廷根的工作得到了德国研究基金会(SPP2191、TRR128-2、TRR274-1、Synergy excellence Cluster、EXC2145、Projekt ID390857198、EXC2067/1-390729940和STA1389/5-1)、ERC(向M.S.提供合并补助金)以及Miriam博士和Sheldon G.Adelson医学研究基金会的资助。赫尔辛基大学的工作得到了赫尔辛基大学和芬兰同事的捐款的支持,我们非常感谢他们。芬兰科学院支持G.B.(318434)、O.V.(336490)、S.J.B.(315950和336471)、J.H.(1308613和1314119)。O.V.得到了Jane和Aatos Erkko基金会以及赫尔辛基大学医院基金的支持(TYH2018322)。S.J.B.得到了瑞典研究基金会和MA的支持,玛丽·斯克罗多斯卡-居里行动(799929)。M.J.由澳大利亚研究理事会的发现早期职业研究人员奖(DE190100565)支持。F.A.M.由澳大利亚国家健康和医学研究理事会高级研究奖学金(GNT1060075)支持。T.T.和A.T.得到了欧洲区域发展基金(项目编号2014-2020.4.01.15-0012)、欢迎信托国际奖学金WT095077 MA、欧洲研究理事会赠款GLIOGUIDE和爱沙尼亚研究理事会(授予T.T.的PRG230和EAG79赠款)的支持。作者供稿:G.B.,M.S.,A.H.构思该项目。L.C.C.,R.O.,L.D.P.,M.D.,J.F.,S.K.,F.v.d.M.,K.K.,M.A.,L.S.设计和执行实验,A.T.,T.T.,L.L.,O.V.,J.H.,O.G.,H.K.K.,P.O.,M.J.,开发和提供工具,L.C.C.,R.O.,L.D.P.。M.D.,J.F.,S.K.,T.K.,C.S.,T.S.,M.J.,F.A.M.,S.J.B.,J.H.,O.V.分析数据或监督数据采集。L.C.C.,R.O.,L.D.P.,M.D.,J.F.,S.K.,T.K.,O.G.可视化数据,T.K.和O.G.进行scRNA-seq数据分析,M.S.W.,B.M.,C.S.,H.K.K.提供人体样本,G.B.和M.S.撰写手稿,G.B.和M.S.监督项目。竞争利益:T.T.、O.V.和G.B.拥有针对抑制SARS-CoV-2的Nrp1b1结构域的单克隆抗体3(MAb3)的专利。数据和材料的可用性:评估论文中的结论所需的所有数据都在论文或补充材料中。本作品在Creative Commons Attribution 4.0 International(CC by 4.0)许可下获得许可,该许可允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用了原始作品。要查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.。本许可证不适用于文章中包含的归第三方所有的图形/照片/插图或其他内容;在使用此类材料之前,请获得版权所有者的授权。