致幻茶阿育吠陀中发现的化合物可以生长新的脑细胞
N,N-二甲基色胺(DMT)是ayahuasca啤酒的一种成分,传统上用于南美多个国家的仪式和治疗目的。在这里,我们已经在体外和体内研究了DMT的潜在神经源性作用。我们的结果表明,DMT的给药可以激活主要的成年神经源性小生境,即海马齿状回的亚颗粒区,从而促进颗粒区中新生成的神经元。此外,与未治疗的对照动物相比,这些小鼠在记忆力测试中表现更好,这暗示了DMT诱导的海马神经元新产生的功能相关性。有趣的是,由于S1R拮抗剂阻断了神经源性作用,DMT的神经源性作用似乎涉及通过sigma-1受体(S1R)激活的信号传导。两者合计,我们的结果表明DMT治疗激活了调节神经干细胞增殖,成神经细胞迁移并促进海马中新神经元生成的颗粒下神经源性生态位,从而增强了成年神经发生并改善了空间学习和记忆任务。
N,N-二甲基色胺(DMT)是一种天然化合物,存在于许多植物物种和植物制剂中,例如被称为ayahuasca 1的致幻剂输注,被归类为致幻剂,可引起人类感知,情感和认知的强烈改变2。参见图3、4。DMT存在于几种动物组织中,例如肺5和脑6,被认为是具有不同生理作用的内源性痕量神经递质,包括神经信号传导和脑/外周免疫学作用7、8、9、10。 DMT还存在于人的血液,尿液和脑脊液11、12、13中。此外,一些证据表明DMT可以螯合并储存在大脑的囊泡系统中,环境压力会增加其在哺乳动物中枢的水平神经系统(CNS)14、15、16。DMT对5-羟色胺受体(5-HT)17、18的亚型1A和2A结合并发挥激动剂活性。这些受体是G蛋白偶联的受体受体(GPCR)属于血清素能受体家族,参与细胞内信号传导的许多级联反应,在CNS的多个区域中高表达。一些研究表明,DMT还以低亲和力与非血清素能受体(例如sigma-1受体(S1R))结合。 S1R,传统上被认为是阿片受体,现在被归类为孤儿家族的高度保守的跨膜蛋白成员,并且主要位于内质网的膜中。 σR-1广泛存在于中枢神经系统中,主要分布在前额叶皮层,海马和纹状体19中。有趣的是,在哺乳动物中,σR-1的天然内源性配体之一是DMT14。该受体与多种细胞功能有关包括大脑在内,例如脂质运输,代谢调节,细胞分化,信号传导(响应压力),针对氧化剂的细胞保护,髓鞘形成以及最近发生的神经发生20、21、22、23、24。
神经发生是产生新的功能性神经元的过程,主要在SVZ和海马DG的亚颗粒区。在哺乳动物中,此过程主要发生在产前,在成年25、26、27、28、29、30的成年人中明显减少。在人类中,尽管最近在成年31、32、33,大多数研究表明,没有足够的证据支持它。 Duque and Spector的最新评论表明,在成年时代,与生成新神经元相比,保存现有神经元更为重要。34.神经发生是一个复杂的过程,涉及多种细胞活动,包括神经干细胞的增殖(NSC)。 ;祖细胞),迁移和分化,存活,细胞命运和成熟的获取以及这些新生神经元在现有神经元回路中的整合。所有这些过程都受到多种因素的精确调控35。这些因素及其作用机理的知识发展可以帮助我们研究可能的新工具,这些工具将使我们能够扩大成年大脑有限的内源性神经源性能力,因此为开发有效的治疗脑损伤和神经退行性疾病的疗法开辟了新领域。
神经退行性疾病(包括帕金森氏症,阿尔茨海默氏症,洪廷顿氏症等)和急性神经损伤(如中风和脑外伤)的特征是神经系统受影响区域神经元的逐渐选择性丧失。这些疾病的一个共同特征是神经源性壁36 36、37中祖细胞的增殖受到损害。在具有阿尔茨海默氏病病理特征的动物模型中,SVZ 38中描述了神经源性能力的丧失。帕金森氏病患者的死后大脑中也观察到这一现象,这表明神经源性活动的丧失是由于多巴胺的丧失,从而影响了成年人的神经前体39。不仅发生成熟神经元的变性和死亡,而且在成年大脑中新神经元祖细胞的形成过程也受到不利影响。根据这些数据,刺激内源性干细胞和神经元祖细胞可能是改善受神经退行性病变影响的某些区域功能的有前途的方法。实际上,已经提出刺激神经发生作为精神和神经疾病的新治疗策略40、41、42、43、44,并且一些研究报告说抗抑郁药的临床疗效通常与抗抑郁药的能力有关。这些药物可诱导神经发生45,46,47,48。
基于上面提到的数据,包括我们对Ayahuasca 49其他成分有效神经源性作用的结果,这项工作的主要目的是分析DMT在成人神经发生中的可能作用,并阐明其作用机理。 。
按照动物实验程序和协议,由生物医学研究所(CSIC-UAM)专门批准的动物实验程序和规程,使用成年雄性C57 / BL6小鼠(3个月大)进行了实验。符合欧洲共同体理事会指令2010/63 / EEC和国家法规RD1386 / 2018。采取了足够的措施以最小化小鼠遭受的疼痛或不适。
从成年小鼠海马的亚颗粒区(SGZ)分离NSC,并制备以下先前描述的方法49。总共使用24只动物,分为四个不同的库(六个动物/池)。简要地,仔细地解剖组织,在具有谷氨酰胺,庆大霉素和真菌区的DMEM培养基中解离,然后在37℃下用0.1%胰蛋白酶-EDTA + + 0.1%DNAse + + 0.01%透明质酸酶消化15分钟。将分离的干细胞以密度约为40,000个细胞/ cm 2的密度接种到六孔培养皿中的DMEM / F12(1:1)中,其中含有10μng/ mL表皮生长因子(EGF),10μng/ mL成纤维细胞生长因子( FGF)和N2培养基。
在标准条件下培养1周后,形成了富含神经祖细胞的小生长球体,称为神经球(NS)。此时,所有NS具有相同的阶段和大小,每天在培养条件下(在存在外源性生长因子,EGF和FGF的情况下)用赋形剂或DMT(1μM)处理培养物,持续7天。某些培养物分别用与DMT结合的不同受体的拮抗剂分别以1μm预处理1μh,时间为BD1063(BD,sigma-1R),甲硫基噻吩(Met,5-HT1A / 2A),利坦色林(Rit,5-HT2A )和WAY100635(WAY,5-HT1A)。在该剂量下,没有一种受试药物影响培养细胞的活力(数据未显示)。
在有无化合物存在下培养7天后,评估增殖和生长分析,并使用Nikon Digital Sight SD-L1软件对每种条件下10孔中NS的数量和大小进行定量。每个条件下至少定量了50个神经球。接下来,将这些增殖性NS中的一些用于免疫印迹分析,而另一些则播种到盖玻片上,并在分化条件下(24-h)(含培养基1%的胎牛血清,无外源性生长因子)。然后在不超过20分钟的时间内将NS固定在4%的低聚甲醛中,然后使用特异性抗体进行增殖的免疫细胞化学分析。培养剩余的NS用于分化研究。
为了确定DMT刺激神经元,星形胶质细胞或少突胶质细胞形成的能力,将来自7天龄培养物的NS接种到聚赖氨酸包被的六孔板和/或盖玻片上,并在DMT存在下进行培养(在分化条件下(含1%胎牛血清且无外源性生长因子的培养基)加入1μM)和/或DMT +拮抗剂(1μM)。一旦分化了神经球(72 h),将在包被的六孔板上生长的神经球用于免疫印迹,将在盖玻片上的神经球用于免疫细胞化学分析。
将涂有涂层的六孔板上培养的NS重悬于带有蛋白酶抑制剂混合物(Roche)的冰冷细胞裂解缓冲液(Cell Signaling Technology)中,并在冰上孵育15-30分钟。将总量为30μg的蛋白质上样到10%或12%SDS-PAGE凝胶上,并转移到硝酸纤维素膜(Protran,Whatman)上。将膜在含0.05%Tween-20和5%脱脂奶或4%BSA的Tris缓冲盐水中封闭,与一抗和二抗孵育,并根据标准程序洗涤。图中的值是对应于具有三个独立实验/池的四个不同细胞库的12个印迹的定量平均值。
培养1周后,当形成NS后,使用兔抗sigma-1受体抗体(Abcam ab53852)和小鼠抗Nestin抗体(Abcam ab6142)进行免疫染色。在治疗期结束时,将玻璃盖玻片上生长的NS在室温下于4%多聚甲醛中固定15–20 min,用0.1%Triton X-100透化,并在37 C下与相应的一抗孵育1 incubatedh 。然后将细胞用PBS洗涤,并与Alexa-488山羊抗兔抗体和Alexa-647山羊抗小鼠抗体(1:500,Molecular Probes)在37°C下孵育45分钟。为了研究增殖,使用了兔抗ki67(1:200,Abcam ab833)抗体。为了将NS分化为不同的神经细胞类型,使用了下一种抗体:兔β-III-微管蛋白(1:400,TuJ-1克隆; Abcam ab68193)和小鼠抗MAP-2(1:200,小鼠;小鼠)。 Sigma M4403)用于神经元;鼠抗GFAP(1/500,Sigma G3893)用于星形胶质细胞,兔抗CNPase(1:100,Cell Signaling#2986)作为少突胶质细胞标记。使用4',6-二mid基-2-苯基吲哚(DAPI,1/500)进行细胞核染色。最后,在LSM710激光扫描光谱共聚焦显微镜(Zeiss)中获取图像。调整共焦显微镜设置以产生最佳的信噪比。显示了来自四个不同细胞池的至少八个神经球/病症的代表性图像。
根据所进行的治疗,将居住在12小时明暗循环动物设施中的小鼠分开。 (1)短期动物(每个实验组n == 5),连续4天每天单独或与拮抗剂BD1063结合使用DMT(每公斤体重2μg毫克)腹膜内(ip)注射。 1R),甲硫基噻吩(5-HT1A / 2A),利坦色林(5-HT2A)和WAY100635(5-HT1A)。在第4天,给小鼠腹膜内(ip)注射5-溴-2-脱氧尿苷(BrdU;50μg/ kg),并在第5天处死。(2)长期小鼠(每个实验组n = 5)。每隔一天收到一个IP连续21天单独或与相应的拮抗剂联合注射DMT(每公斤体重2微克2毫克)。为了标记增殖细胞以进行长期的存活和分化研究,在第1天给小鼠腹膜内注射BrdU(50μg/ kg)。所有腹膜内治疗均在注射盐酸高铁(1μg/ kg,ip)后1μh进行。根据先前的研究14、50、51选择化合物的剂量。
治疗后,将先前麻醉过的动物经4%多聚甲醛溶液进行心内灌注,并按照先前所述52处理大脑。然后将切片与抗sigma 1受体兔(Abcam ab53852)和抗nestin小鼠(Abcam ab6142)一起孵育,抗BrdU小鼠单克隆抗体(DAKO M0744)与抗Nestin兔(Abcam ab7659),抗NeuN兔(Millipore ABN78)或抗doublecortin(DCX,Santa Cruz sc-8066)抗体在4°C下过夜,洗涤三遍,并与AlexaFluor 488山羊抗小鼠和Alexa-647山羊抗兔二抗在室温下孵育1小时。冲洗后,将切片用Vectashield固定。使用LSM710激光扫描光谱共聚焦显微镜(Zeiss)获得图像。调整共焦显微镜设置以产生最佳的信噪比。分析每个实验组的五只动物。
为了估计被特定标记染色的细胞总数,对含有SGZ的脑冠状切片使用了改良的立体学方法,如先前所述53。用图像处理包Fiji 54处理图像。每组使用五只小鼠。通过将标记的细胞/结构部分的平均数目乘以包含DG的30μm厚的切片总数,将结果表示为海马DG中标记的细胞总数。值代表来自三个不同实验和五个动物/实验/实验组的平均值。 ** P≤0.01。
为了进行行为研究,将小鼠腹腔注射。在连续21天内,按上述方法单独注射DMT(2μg/ kg)或与利坦色林(0.2μg/动物)联合注射。然后在10天之内按照前述45进行行为分析,最后在第31天处死动物。向对照动物注射溶媒。注射盐酸克洛瑞林(1μg/ kg,ip)后1h给予所有腹膜内治疗。每个实验组使用十二只动物。
没有使用统计方法来确定每个实验的样本量。样本量和动物数量是根据我们以前的研究估算的。对于动物研究,未使用随机化。来自图1和2的统计分析数据。使用单向方差分析分析1–5。在图5中,使用双向混合方差分析分析了来自学习曲线和提示学习的数据。在使用ANOVA确认主要发现的意义后,将显着性水平P << 0.05应用于所有剩余的事后统计分析(Tukey检验)。用于Windows(芝加哥,伊利诺伊州)的SPSS统计软件包(版本20.0)用于所有统计分析。
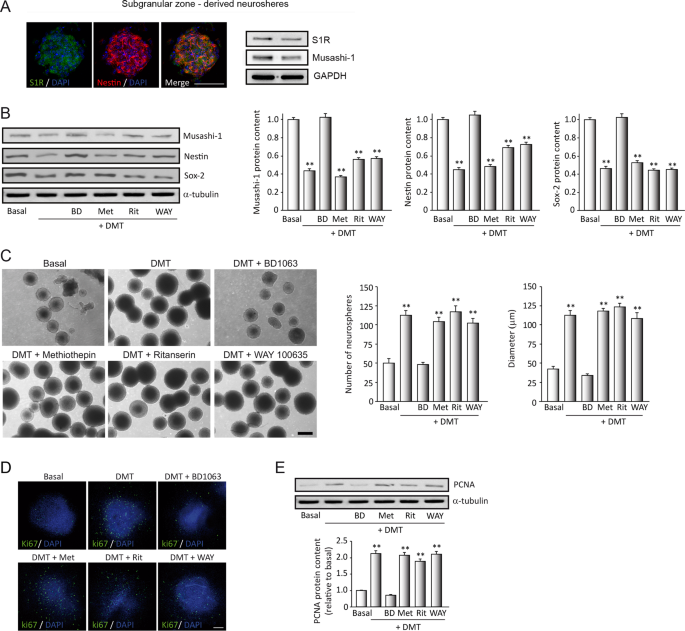
SGZ衍生的神经球(NS)在7天内分别用DMT或与拮抗剂BD1063(BD),Methiothepin(Met),ritanserin(Rit)和WAY100635(WAY)组合治疗。 a通过免疫细胞化学(n = 8个神经球)和蛋白质印迹分析(n = 12个印迹)确定的神经干细胞(NSC)(红色标记为Nestin)上S1R(绿色)的表达。 b代表性的蛋白质印迹和定量分析显示了干细胞标记物musashi-1,nestin和SOX-2在NSC中的表达水平。 c代表性的相衬显微照片,显示了NS的形成以及NS的数量和直径的量化(每种情况n == 50个神经球)。比例尺= 100μm。 d共聚焦荧光图像显示处理后NS中增殖ki67(绿色)的细胞标记物的表达(每种情况n = 8)。 DAPI用于核染色。比例尺= 50μm。 e代表性的蛋白质印迹和定量显示了NS中增殖细胞核抗原(PCNA)的水平。条形图中的值表示在三个独立的实验/池中,四个不同细胞池的定量平均值±SD(n = 12印迹)。在使用ANOVA确认主要发现的意义后,将显着性水平P << 0.05应用于所有剩余的事后(Tukey检验)统计分析。 ** P≤0.01表示与未处理(基础)培养物相比有显着结果。
SGZ衍生的神经球在DMT单独存在下或与拮抗剂BD1063(BD),美托西平(Met),利坦色林(Rit)和WAY100635(WAY)结合存在下培养7天,然后粘附在基质上并允许区分3天。 a共聚焦荧光图像,显示神经元标志物β-III-微管蛋白(TuJ-1克隆,绿色)和MAP-2(红色)在NS中的表达(每种条件下n = 8)。 DAPI用于核染色。比例尺= 50μm。 b代表性的蛋白质印迹法和对β-微管蛋白和MAP-2的定量。 c免疫荧光图像显示NS表达染色星形胶质细胞的神经胶质纤维酸性蛋白(GFAP,红色),绿色表达少突胶质细胞标记CNPase(每种情况下n = 8)。 DAPI用于核染色。比例尺= 50μm。 d CNPase和GFAP的代表性蛋白质印迹和定量。结果是四个不同细胞池的平均值±SD,三个独立的实验/池(n = 12)。在使用ANOVA确认主要发现的意义后,将显着性水平P << 0.05应用于所有剩余的事后(Tukey检验)统计分析。 ** P≤0.01; *** P≤0.001表明与未处理的(基础)培养物相比有显着的结果。
a代表图像(n = 3的动物)显示了sigma-1受体(S1R,绿色)在齿状回亚颗粒区神经干细胞(NSCs)(红色标记为nestin)上的表达。 S1R表达也通过蛋白质印迹法在海马组织上测定(n = 3)。 b用于体内短期神经源性研究的实验设计和治疗计划的示意图。每天在4天内腹膜内注射DMT单独或与拮抗剂BD1063(BD),美托西平(Met),利坦色林(Rit)或WAY100635(WAY)结合使用。为了标记增殖细胞,在第4天对小鼠进行腹膜内注射。注射5-溴-2-脱氧尿苷(BrdU)并在第5天处死。c共聚焦最大强度投影图像显示成年小鼠SGZ上BrdU / Nestin共染色。 BrdU以绿色显示,nestin以红色显示。比例尺= 25μm。 d显示了在共焦正交图像上进行的DG中BrdU / Nestin双细胞数量的量化。 e在SGZ中表达BrdU + -DCX +的双细胞。共焦最大强度投影图像显示绿色的BrdU和红色的DCX。比例尺= 25μm。 f显示了DG中BrdU +-DCX +细胞的数量的定量。所有定量值均代表平均值±标准差(每组n = 5只动物)。在使用ANOVA确认主要发现的意义后,将显着性水平P << 0.05应用于所有其他事后(Tukey检验)统计分析。 ** P≤0.01; *** P≤0.001表示与媒介物处理的(基础)动物相比有显着结果。
体内长期神经源性研究的实验设计和治疗计划的示意图。单独或组合使用DMT