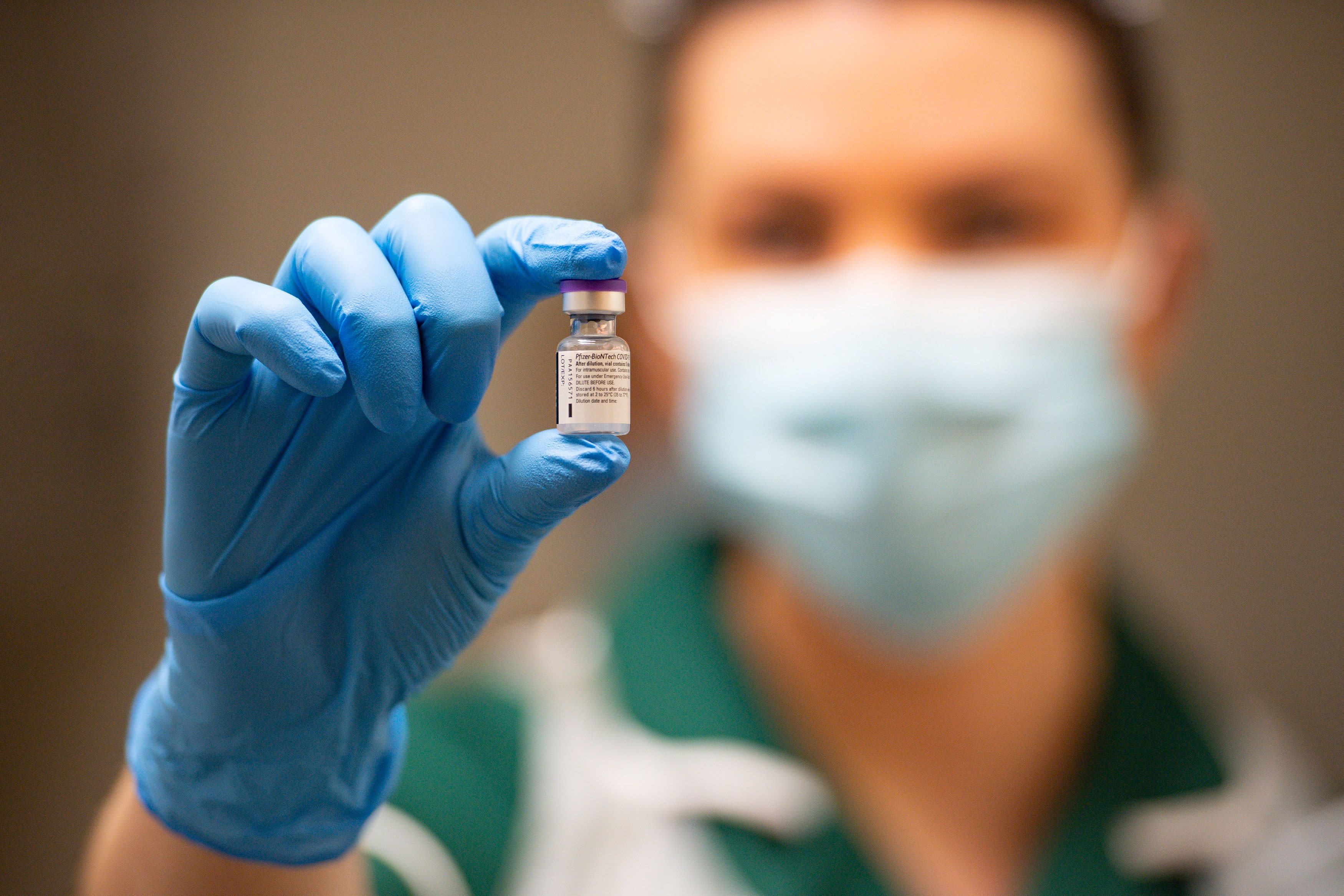
FDA推荐辉瑞Covid-19紧急疫苗
美国食品和药物管理局的一个重要咨询小组以17票对4票,一名委员在星期四弃权,建议批准辉瑞和BioNTech冠状病毒疫苗用于紧急用途,这是FDA最终批准广泛分发全美首剂。
如果FDA接受疫苗和相关生物产品咨询委员会的不具约束力的建议-这是可预期的-这将标志着Covid-19大流行的关键时刻,该大流行已经感染了超过1,540万人,并在美国杀死了大约290,000。不到一年。
该委员会在批准美国流感和其他疫苗方面发挥着关键作用,以确保注射疫苗可以安全地用于公众。尽管FDA不必遵循咨询委员会的建议,但通常会这样做。
该委员会成员詹姆斯·希尔德雷斯(James Hildreth)告诉NBC今日周末,FDA最早可以在周五授予辉瑞疫苗的紧急使用授权。周六。当机构继续评估安全性数据时,紧急使用授权或EUA通常允许将药物或疫苗施用于有限的人群或场所,例如住院患者。
目前尚不清楚FDA是否会授权辉瑞和BioNTech疫苗用于某些人群。包括孕妇和幼儿在内的一些人可能将不得不等待在美国获得疫苗,直到辉瑞公司可以完成针对这些特定人群的试验。 FDA周二表示,目前尚无足够的数据得出有关该疫苗在16岁以下儿童,孕妇和免疫系统受损人士中的安全性的结论。加拿大,英国和巴林的监管机构已清除了该疫苗供大多数成年人使用。
委员会建议对16岁以上的人紧急批准该疫苗。在投票之前,会议上的一些专家争辩说将其建议限制为至少18岁的人,他们说16岁和17岁的孩子的安全性数据“很薄”。
"我只想加入那些拥护这个话题的人。 ..我认为数据非常薄,鉴于疾病的发病率很低,不足以真正说出我们的安全性。加利福尼亚大学圣地亚哥分校医学院的专家小组成员和传染病专家Mark Sawyer博士在会议上说。
EUA与完全批准不同,通常可能需要几个月的时间。辉瑞仅提交了两个月的后续安全数据,但该机构通常需要六个月才能获得完全批准。
辉瑞公司首席执行官阿尔伯特·布尔拉(Albert Bourla)在投票后的一份声明中说,公司感到“高兴”。如果获得FDA的批准,请随时准备将这种疫苗带给美国民众,以帮助对抗这种毁灭性的大流行。
美国官员说,他们准备在授权后的24小时内分发疫苗。随着制造业的发展,初始剂量将受到限制,官员们预测,要给美国每个想要接种疫苗的人免疫,将需要几个月的时间。辉瑞公司已经表示,计划今年运送5000万剂疫苗,足以接种2500万人。预计该疫苗将分阶段分发,其中最关键的美国工人和弱势人群将首先获得该疫苗。疾病控制与预防中心已向各州提供了大纲,建议首先优先安排医护人员和疗养院,但各州可以根据自己的意愿分配疫苗。
疾病预防控制中心国家免疫和呼吸中心主任南希·梅森尼尔博士(Nancy Messonnier)说,美国官员计划继续在接受该疫苗的卫生保健工作者和疗养院居民中观察辉瑞疫苗的任何不良反应。疾病在周四的机构会议上说。官员将使用称为v-safe的短信系统,旨在提供有关疫苗可能产生的不良反应的早期迹象。
上周授权辉瑞疫苗用于紧急用途的英国于周二开始大规模接种疫苗。在向英国民众广泛分发之前,将疫苗接种给一线卫生工作者,疗养院工作者和80岁以上的人。
辉瑞的疫苗使用信使RNA或mRNA技术。这是一种使用遗传物质激发免疫反应的疫苗新方法。后期临床试验数据显示,该疫苗对预防Covid疫苗有效率为95%,安全并且似乎可以抵御严重疾病。为了获得最大效力,疫苗需要间隔大约三周服用两次。
FDA表示将批准安全且至少50%有效的Covid-19疫苗。相比之下,据CDC称,与未接种疫苗的人相比,流感疫苗通常将人们患流感的风险降低了40%至60%。
会议召开前两天,FDA在其网站上发布了文件,称辉瑞公司提交的试验数据与该机构提出的紧急使用建议一致。它还证实了这种疫苗是高效的,没有引起任何重大的安全隐患,并补充说,对于儿童,孕妇和免疫系统受损的人,仍需要更多有关该疫苗的安全性数据。
在会议期间,FDA疫苗审查员Susan Wollersheim博士指出,试验数据显示"数值失衡"如果是贝尔氏麻痹,会导致面部肌肉暂时性无力或瘫痪。她说,疫苗组有4例,安慰剂组无。尽管病例的发生率不超过普通人群的发生率,但如果疫苗被批准用于更广泛的用途,则FDA建议进一步监测。
辉瑞的疫苗的储存温度为华氏零下94度,这对可能没有良好医疗保健基础设施的农村地区和内城区提出了后勤方面的挑战。相比之下,Moderna表示,其疫苗在华氏零下4度下可以保存六个月。
唐纳德·特朗普总统的冠状病毒疫苗沙皇孟塞夫·斯劳伊博士(Moncef Slaoui)表示,到2月底,美国应该能够分发足够数量的冠状病毒疫苗,以免疫一亿美国人,占美国人口的近三分之一。他曾表示,到6月,整个美国人群都可以接种针对Covid-19的疫苗。
辉瑞公司上周表示,其在美国和欧洲的全面生产线现已完成,并且充满信心。它将能够提供目标剂量。