发现阿尔茨海默氏症的生物标志物受睡眠周期的调节
圣路易斯华盛顿大学医学院(WUSM)的科学家们花了几年时间研究昼夜节律与阿尔茨海默氏症之间的联系,最近又取得了一些实际进展。在2018年的一项研究表明睡眠中断如何加速与疾病相关的毒性斑块的形成之后,研究小组现已鉴定出一种与疾病进展有关的蛋白质,该蛋白质似乎受到昼夜节律的高度调节,从而帮助他们扎根并提供潜在的新治疗靶标。
WUSM小组在之前的研究中着手研究破坏自然睡眠周期或昼夜节律如何加速大脑中淀粉样斑块的积累,而这些斑块与阿尔茨海默氏病密切相关。通过对人类和小鼠的研究,研究小组能够显示两者之间的密切相关性。现在,通过后续工作,研究小组已经鉴定出一种似乎在这种关系中起作用的脑蛋白。
有问题的脑蛋白被称为YKL-40,多年来一直是阿尔茨海默氏症的生物标志物,因为在患有这种疾病的人的脑脊液中发现了高水平的蛋白质,而且随着疾病的发展,这些蛋白质的含量也在增加。研究人员正在筛选受昼夜节律调节的基因,并很感兴趣地看到这种脑蛋白的基因突然出现。
“ YKL-40的基因受到时钟基因的高度调控,”资深作者Erik Musiek说。 “这真的很有趣,因为它是阿尔茨海默氏病的著名生物标志物。”
之后,研究小组通过研究在有和没有关键昼夜节律基因的炎症条件下,制造了多少蛋白质,从而研究了YKL-40与阿尔茨海默氏症之间的这种联系,其特征是慢性炎症。确实,这表明昼夜节律控制了产生多少YKL-40。
“如果早晨发炎,您可能会服用大量YKL-40;如果您在晚上发炎,而时钟处于另一个相位,则可能会减少YKL-40,” Musiek说。
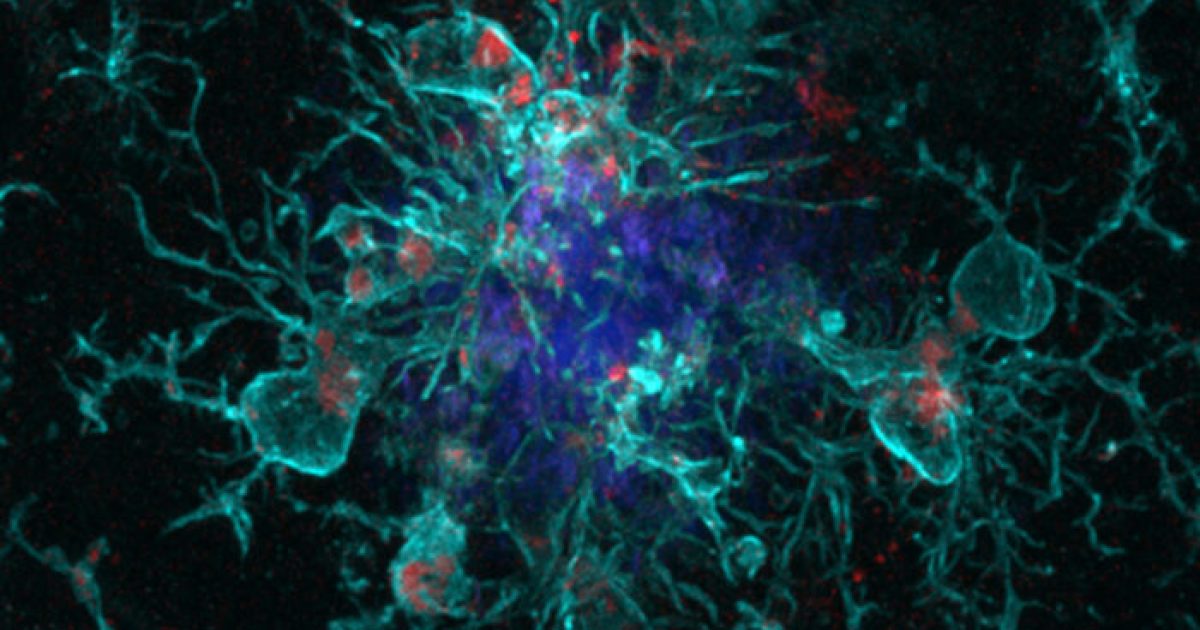
接下来,研究小组与容易产生淀粉样斑块的小鼠一起工作,并对其中一组缺乏YKL-40基因的基因进行了基因修饰。随着小鼠的衰老,研究小组分析了他们的大脑,发现没有YKL-40蛋白的小鼠的淀粉样斑块大约是对照组的一半。
研究小组深入研究了原因,发现缺乏YKL-40基因的小鼠具有更多的小胶质细胞,它们是围绕淀粉样蛋白斑块并阻止其扩散的免疫细胞。从本质上讲,这意味着这些小鼠具有更多的饥饿免疫细胞,可以吞噬淀粉样蛋白。
Musiek说:“ YKL-40蛋白可能充当大脑中小胶质细胞激活水平的调节剂。” “当您除去蛋白质时,似乎小胶质细胞被激活得更多,可以吃掉淀粉状蛋白。这是一个微妙的事情,是系统中的一个调整,但似乎足以大大减少淀粉样蛋白的总负担。”
研究小组还在人类受试者中研究了这一想法,利用了来自衰老和痴呆研究的778名受试者的遗传数据,发现其中只有四分之一具有降低YKL-40水平的遗传变异,并且认知功能下降的速度慢了16%在那个小组中。
Musiek说:“如果您的昼夜节律时钟不正确多年,您通常会在晚上睡不着觉,白天会打n,那么慢性失调的累积作用可能会影响炎症途径,从而使您积累更多的淀粉样斑块。” “我们希望对生物钟如何影响YKL-40的更好理解可以导致减少大脑淀粉样蛋白的新策略。”