可溶性血管紧张素转换酶2有望用于治疗严重冠状病毒
佐法利等人最近的一项研究。发表在《柳叶刀呼吸医学》杂志上的文章描述了首例成功使用重组人可溶性血管紧张素转换酶-2(HrsACE2)治疗的重症新冠肺炎患者的令人鼓舞的数据。1发表的数据文件介绍了治疗获得性免疫反应、病毒从血清、鼻腔和肺部迅速消失,以及炎性细胞因子水平的降低,这些都是新冠肺炎病理中的关键因素。值得注意的是,hrsACE2的使用没有阻碍中和抗体的产生,导致治疗患者的临床显著改善。
严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)的大范围传播导致了100多万人因新冠肺炎死亡。因此,对病毒病理生理学的重要认识可能有助于寻找有效的疫苗和治疗方案。除了寻找病毒复制抑制剂,另一种策略是阻断病毒的细胞靶点--血管紧张素转换酶-2(ACE2)。2个。
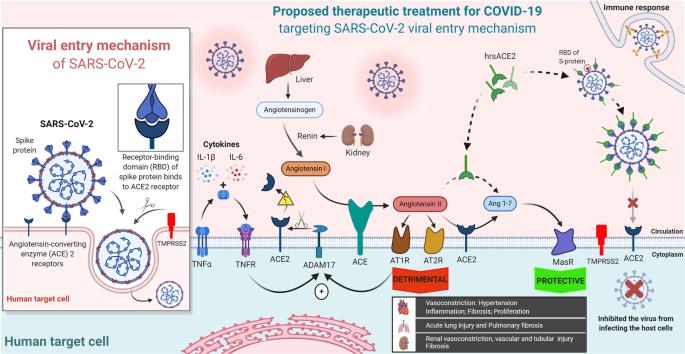
ACE2是SARS-CoV-2的重要受体靶点,在新冠肺炎的发病机制中起着至关重要的作用,因为它能使病毒进入靶细胞(图2)。1)。ACE2与SARS-CoV-2刺激性糖蛋白受体结合域(RBD)的结合亲和力比SARS-CoV的RBD高10~20倍,这可能是SARS-CoV-2感染的更高致病机制的基础。ACE2是一种跨膜蛋白,通常以其羧肽酶活性和在肾素-血管紧张素系统中的生理作用而闻名。血管紧张素转换酶2将血管紧张素II水解为其代谢物,血管紧张素1-7和血管紧张素I为血管紧张素1-9,以保护不同的组织免受损伤(图2)。1)。3血管紧张素转换酶2在人体多个器官中均有不同程度的表达。它在肺(在II型肺泡上皮细胞表面)、心脏(在心肌细胞、冠状动脉血管内皮细胞和血管平滑肌)、肾脏(在近端小管细胞)和小肠(在肠细胞)高表达。
肾素-血管紧张素系统示意图及针对SARS-CoV-2病毒进入机制的新冠肺炎治疗建议。(左)SARS-CoV-2刺突蛋白的受体结合域(RBD)与血管紧张素转换酶2(ACE2)结合,允许宿主细胞进入和感染。TMPRSS2代表跨膜蛋白酶丝氨酸2。(中)ACE2在肾素-血管紧张素系统中的生理作用及其对器官的保护作用。肾素是肾小球旁细胞产生的一种蛋白酶,它能分解血管紧张素原(肝脏产生的血管紧张素的前体)生成血管紧张素。血管紧张素转换成血管紧张素的过程中,血管紧张素转换成血管紧张素。血管紧张素II可能通过血管紧张素II受体1和2受体(AT1R和AT2R)发挥一定的生物学功能,导致多个器官的强烈的血管收缩。AT1R的激活增加了跨膜蛋白酶(ADAM17)的活性。此外,肿瘤坏死因子-α激活其肿瘤坏死因子受体是另一种增加ADAM17活性的途径。肿瘤坏死因子-α与SARS-CoV-2感染所释放的细胞因子一起可导致细胞因子风暴。ADAM17裂解ACE2的胞外膜旁区域,目前尚不清楚ACE2裂解是否与SARS的发病有关。血管紧张素转换酶2将血管紧张素II水解为血管扩张剂血管紧张素1-7,血管紧张素1-7与Mas受体结合,对多个器官起保护作用。ACE/Ang II/AT1R和ACE2/Ang 1-7/MASR之间的平衡对维持正常健康至关重要。(右)根据最近的研究,在组织部位增加hrsACE2可以有效地与内源性ACE2竞争,限制SARS-CoV-2进入宿主细胞,降低血管紧张素II水平。1、4注射hrsACE2不能减少抗SARS-CoV-2 IgA和IgG抗体的产生。
膜结合的ACE2可能介导SARS-CoV-2的细胞进入,而一种被称为hrsACE2的转基因可溶性ACE2可能会减少SARS-CoV-2与膜结合的ACE2竞争的细胞进入。APN001是ApeIron Biologics公司设计的一种模仿人类ACE2酶的hrsACE2。因此,它可能会减少SARS-CoV-2的细胞进入,以最大限度地减少肺损伤和多器官功能障碍(图3)。1)。这一理论得到了体外研究的实验支持,研究表明,hrsACE2在细胞培养、工程血管和肾脏器官中将SARS-CoV-2的病毒生长抑制了1000-5000倍。4到目前为止,hrsACE2已经在89名I期研究的健康志愿者和II期临床研究的急性呼吸窘迫综合征患者中被证明是安全和耐受的。APN01作为一种很有前途的治疗新冠肺炎的药物,具有诱人的潜力和良好的科学依据。
在这里,佐法利和同事们
2.沃尔斯(Walls),A.C.等人。SARS-CoV-2刺突糖蛋白的结构、功能和抗原性。181,281-292.e286(2020)。
3.Kuba,K.等人。血管紧张素转换酶2(ACE2)在SARS冠状病毒致肺损伤中的重要作用。纳特。医学部。11,875-879(2005)。
4.Monteil,V.等人。临床级可溶性人血管紧张素转换酶2对工程人体组织中SARS-CoV-2感染的抑制作用。181,905-913.e907(2020)。
5.哈施克(Haschke,M.)等人。重组人血管紧张素转换酶2在健康人体内的药代动力学和药效学。克莱恩。药代动力学52,783-792(2013)。
开放获取本文遵循知识共享署名4.0国际许可,该许可允许以任何媒介或格式使用、共享、改编、分发和复制,只要您给予原始作者和来源适当的信用,提供到知识共享许可的链接,并指出是否进行了更改。本文中的图片或其他第三方材料包括在文章的CreativeCommonsLicense中,除非在材料的信用额度中另有说明。如果材料未包含在文章的“知识共享许可”中,并且您的预期用途未得到法定法规的允许或超出了允许的用途,则您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.