T细胞免疫是新冠肺炎异质性背后因素的直接证据
关于人类对SARS-CoV-2病毒的免疫反应存在许多未知数。据报道,SARS-CoV-2反应性CD4+T细胞在未接触过SARS-CoV-2的个体中被报道,这表明在20-50%的人中预先存在交叉反应性T细胞记忆。然而,这些T细胞的来源一直是推测的。使用2019年发现SARS-CoV-2病毒之前提取的人类血液样本,我们在SARS-CoV-2基因组中映射了142个T细胞表位,以便于精确询问SARS-CoV-2特异性CD4+T细胞谱系。我们展示了对SARS-CoV-2和常见感冒冠状病毒HCoV-OC43、HCoV-229E、HCoV-NL63或HCoV-HKU1具有相当亲和力的一系列预先存在的记忆CD4+T细胞。因此,斑驳的T细胞对引起普通感冒的冠状病毒的记忆可能至少是新冠肺炎病观察到的广泛异质性的一部分基础。
2019年末出现的SARS-CoV-2及其随后的全球传播已导致数百万人感染,并导致大量发病率和死亡率(1)。冠状病毒病2019年(新冠肺炎),由SARS-CoV-2感染引起的临床疾病,范围从轻度自限性疾病到急性呼吸窘迫综合征和死亡(2)。新冠肺炎疾病严重状态谱背后的机制,以及针对新冠肺炎的保护性免疫的性质目前尚不清楚。
对SARS-CoV-2人体免疫应答的研究已经开始表征SARS-CoV-2抗原特异性的T细胞应答(3-8),多项研究描述了急性新冠肺炎患者T细胞亚群的显著活化(9-13)。令人惊讶的是,对5个不同的队列进行的抗原特异性T细胞研究报告说,没有接触过SARS-CoV-2的人中有20-50%的人对对应于SARS-CoV-2序列(3-7)的肽有显著的T细胞反应性。这些研究来自地理上不同的人群(美国、荷兰、德国、新加坡和英国),观察到的一般模式是,在未暴露的个体中发现的T细胞反应性主要是由CD4+T细胞介导的。据推测,这种现象可能是由于先前存在的对人类“感冒”冠状病毒(HCoV)的记忆反应,如HCoV-OC43、HCoV-HKU1、HCoV-NL63或HCoV-229E。这些HCoV与SARS-CoV-2有部分序列同源性,在普通人群中广泛传播,通常导致轻微的呼吸道症状(14-16)。然而,SARS-CoV-2与普通感冒HCoV的交叉反应免疫假说仍有待实验验证。这种潜在的针对SARS-CoV2的潜在交叉反应性T细胞免疫具有广泛的意义,因为它可以解释新冠肺炎临床结果的不同方面,影响群体免疫的流行病学模型(17,18),或者影响新冠肺炎候选疫苗的性能。
为了确定以前没有接触过SARS-CoV-2表位的个体中CD4+T细胞识别SARS-CoV-2表位的谱系,我们使用15肽池体外刺激PBMCs 2周。已知该方法对于检测低频T细胞对变应原、细菌或病毒抗原(19、20)(包括幼稚T细胞(21))的反应是稳健的。为了筛选SARS-CoV-2表位,我们利用了2015年3月至2018年3月收集的未暴露对象的PBMC样本,远远早于SARS-CoV-2的全球传播。未暴露的受试者被确认为SARS-CoV-2血清阴性(图2)。(S1a)。
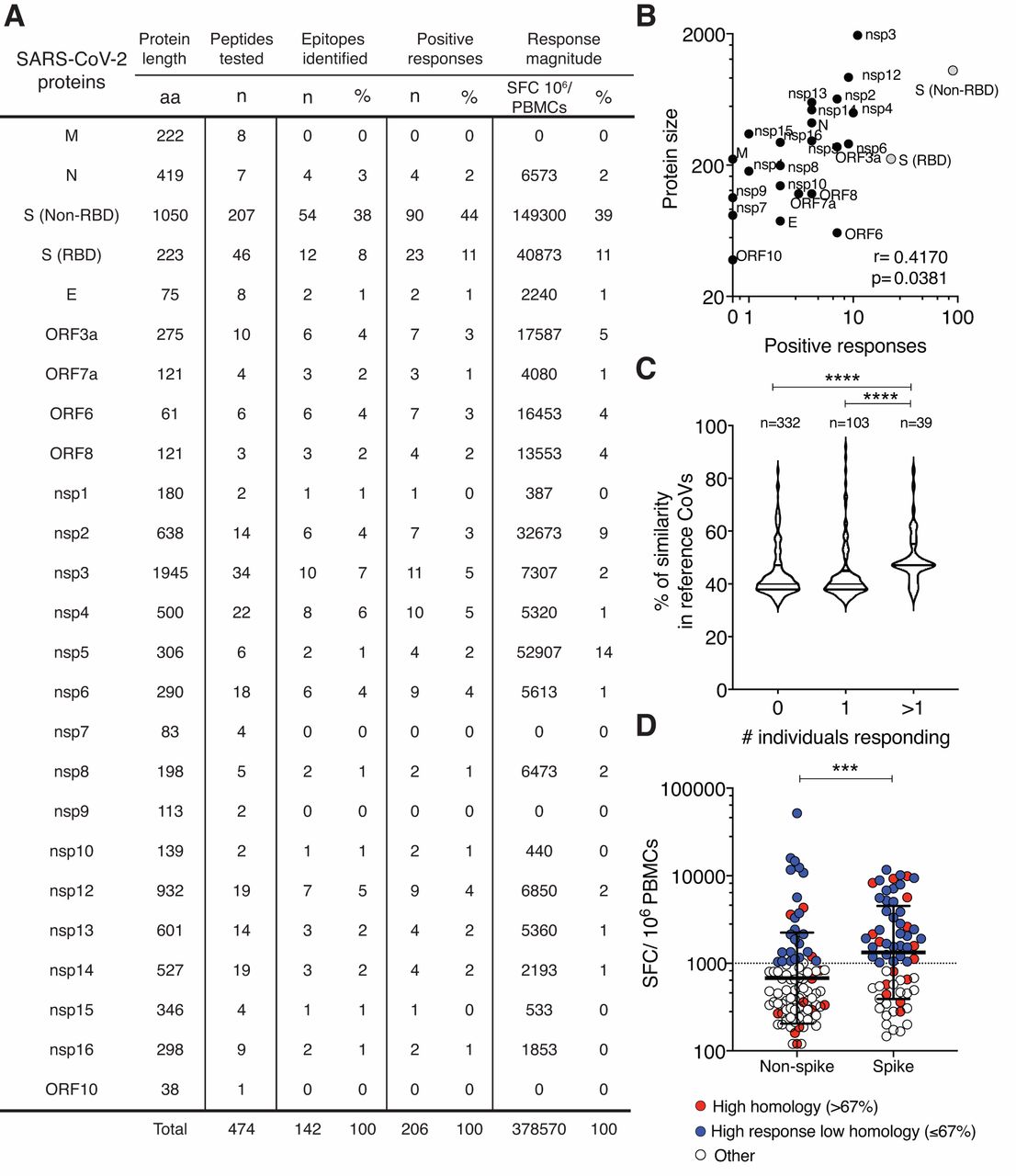
SARS-CoV-2反应性T细胞用横跨整个尖峰蛋白序列(CD4-S)的多肽池,或来自病毒基因组非尖峰区域(即“剩余”)的预测表位的非尖峰“巨池”(CD4-R)扩增(4)。共筛选出474个15聚体SARS-CoV-2多肽。刺激14天后,使用荧光SPOT分析(例如,22个CD4-R中胚醇;图1)检测T细胞对中间“中胚醇”的反应性,每个中胚醇包括大约10个肽。(S2A)。阳性的中孔进一步去卷积以确定SARS-CoV-2的特异性表位。来自一位捐赠者的代表性结果显示,介孔蛋白P6和P18的反卷积识别了七个不同的SARS-CoV-2表位(图1)。(S2B)。特异性干扰素-γ的细胞内细胞因子染色试验确定抗原特异性T细胞对SARS-CoV-2中孔的应答是CD_4~+T细胞还是CD_8~+T细胞。S2C)。44个供体/CD4-R介孔醇和40个供体/CD4-S介孔醇组合产生阳性反应的结果如图所示。S2、D和E。根据CD4/CD8应答细胞的比值判断,82/88例(93.2%)对SARS-CoV-2 mesopool刺激反应的细胞明显为CD4+T细胞。4例(4.5%)应答细胞为CD8+T细胞,2例(2.3%)同时由CD4+和CD8+T细胞介导。CD8+T细胞
因此,我们接下来确定了所有142个SARS-CoV-2表位的所有四个广泛传播的HCoV的同源性程度。为了进行分析,我们根据免疫原性将肽分为三组:1)从不免疫原性,2)一个人的免疫原性,或3)两个或更多的个人的免疫原性(图1C)。多个个体识别的肽与单个个体识别或根本不识别的肽相比,序列相似性明显更高(p<;0.0001,双尾Mann Whitney检验)。此外,几乎所有来自用于表位筛选的未暴露队列的供者都对三种广泛传播的普通感冒冠状病毒HCoV(HCoV-NL63,HCoV-OC42,HCoV-HKU1)呈血清阳性(图1)。(S1B)。因此,抗原表位同源性和血清阳性数据表明,SARS-CoV-2和已经在人类人群中建立的HCoV之间存在T细胞交叉反应。
为了更详细地选择要分析的表位亚集,我们绘制了每个供体的每个阳性表位的T细胞反应幅度(图1D)。这一分析证实了尖峰抗原相对于来自基因组其余部分的表位的优势(p<;0.001,双尾Mann Whitney检验)。
接下来,我们选择了两类感兴趣的SARS-CoV-2表位。第一类是来自HCoV的具有潜在交叉反应的表位。我们最初选择了67%的任意截止,因为我们的理由是9聚体是与II类结合的表位区域(23),而且通常除了9-聚体核心区外,还需要一个或两个残基才能最佳识别(24)(图1D,红色)。其次,我们独立筛选与高应答相关的任何表位(顶部~30%;图1D,蓝色)。这导致从SPEKE中选择了31个表位(6个同源性很高,25个为显性反应),组织在一个新的CD4-[S31]池中。类似地,我们产生了一个新的CD4-[R30]池,由来自基因组其余部分的30个表位组成(9个具有高度同源性,21个与强反应相关;图1D)。这些表位库随后被用于进一步的CD4+T细胞研究。
为了直接解决非暴露供者对SARS-CoV-2的反应性是否可以归因于与其他HCoV的交叉反应,我们设计了一个肽库,包含与CD4-R30表位同源的肽,这些表位来自HCoV-229E,HCoV-NL63,HCoV-OC43,HCoV-HKU1和几个其他HCoV(见方法),总共129个HCoV同源物(HCoV-R129;表S2)。同样,我们合成了一个包含与SARS-CoV-2CD4-S31表位库同源的肽库,由来自其他HCoV的潜在表位组成,总共有124个HCoV同源物(HCoV-S124;表S3)。
接下来,我们利用激活诱导标记物试验(AIM test,(25-27))在一组新的未暴露的供体中检测病毒特异性T细胞,这些供体没有用于抗原表位鉴定研究(图2A和表S4),以及一组正在康复的新冠肺炎患者(表S5)。与阴性对照(Dmso)相比,我们检测到对sars-cov-2非尖峰和尖峰多肽的体外显著的CD4+T细胞反应(图2,B和C;p<;0.0001和p<;0.0001,双尾Mann-Whitney,双尾Mann-Whitney,图2,B和C;p<;0.0001和p<;0.0001,双尾Mann-Whitney,图2,B和C;p<;0.0001,双尾Mann-Whitney)。与未暴露的受试者相比,新冠肺炎病例的这些反应增加(图2D,p=0.0015和p=0.0022,双尾Mann-Whitney),正如先前报道的那样(4)。在未暴露的受试者中,与阴性对照相比,CD4-R30和CD4-S31SARS-CoV-2表位池中检测到明显的CD4+T细胞频率(图2B,p=0.0063和p=0.0012,双尾Mann-Whitney)。对来自其他HCoV的相应的HCoV-R129和HCoV-S124同源肽库也发现了显著的CD4+T细胞反应性(图2D;p<;0.0001和p<;0.0001,双尾Mann-Whitney)。用基于同源性选择的肽库检测CD4+T细胞与SARS-CoV-2和其他HCoV之间存在交叉反应的CD4+T细胞在许多个体中的假设是一致的。
与未暴露者相比,新冠肺炎患者对CD4-R30和CD4-S31(图2D,p=0.0008和p=0.0026)的反应性增加,但对HCoV-R129和HCoV-S124的反应性不增加(图2C)。因此,先前存在的CD4+T细胞对HIV表位的反应性受新冠肺炎和新冠肺炎暴露于交叉反应的SARS-CoV-2表位的调节。这些来自新冠肺炎病例的数据不支持这样的假说,即人类冠状病毒暴露可能诱发原始的抗原性SIN现象,从而损害随后对SARS-CoV2表位(28,29)的T细胞应答,至少对于一般病情的新冠肺炎病例是这样。
接下来,我们研究了T细胞对不同表位巨池的体外记忆表型。图3A显示了一个代表性的未暴露供体的结果。未接触过的捐赠者中反应细胞占优势。
这些T细胞株随后被测试对各种冠状病毒同系物的交叉反应性,类似于以前在黄病毒研究中成功的方法(31)。对10/42(24%)的T细胞系(图4,A至J)检测到SARS-CoV-2表位识别与其他HCoV表位识别之间的交叉反应。交叉反应与SARS-CoV-2刺突、N、nsp8、nsp12和nsp13的表位相关。在三个病例中,HCoV类似物是比SARS-CoV-2肽更好的抗原,表明它们可能是同源免疫原(图4,E,I和J)。在两个不同的捐赠者身上测试了一个SARS-CoV-2尖峰表位,结果相似,表明HCoV的交叉反应模式在个体中重复出现。无交叉反应的SARS-CoV-2T细胞系也被显示(图4,K到L和图3)。S4)。如果检测来自更多个体的T细胞株,可能会检测到与这些表位的交叉反应。此外,这些表位可能与其他一些尚未识别的病毒序列同源,或者被在体外培养中扩增的同源幼稚T细胞所识别(32)。此外,只有3/18例强反应表位(在图1D中定义)是交叉反应的,而较弱表位的4/5是交叉反应的(p=0.02,Fisher‘s精确检验)。为了进一步证明非暴露供者的交叉反应确实来自记忆T细胞,我们用CD4-[S31]表位池刺激纯化的记忆和幼稚的CD4+T细胞。14天后,我们检测到记忆性CD4+T细胞培养物对CD4-[S31]肽库的反应,但没有检测到幼稚的CD4+T细胞(图3)。(第8条)。综上所述,这些数据表明,识别常见感冒冠状病毒包括HCoV-OC43、HCoV-HKU1、HCoV-NL63和HCoV-229E的记忆CD4+T细胞可以与SARS-CoV-2中的同源表位发生显著的交叉反应。
接下来,我们检查了每个SARS-CoV2:hCoV表位对的氨基酸序列同源性程度,以及同源性与T细胞交叉反应之间的任何关系,考虑到潜在相关同源性的不同范围。同源性为33-40%的肽对中仅有1%(1/99)发生交叉反应。在47-60%的表位同源性范围内,我们观察到21%(7/33)的病例发生交叉反应。值得注意的是,表位同源性≥67%与57%的病例有交叉反应(21/37;经双尾费舍尔精确检验,p=0.0001或p=0.0033,与33-40%的范围表位或47-60%的范围相比)。观察到抗原表位同源性与CD4+T细胞交叉反应之间的关系。数据表明,如图1D所述的任意选择确实得到了实验数据的支持。因此,~67%的氨基酸同源性似乎是一个有用的基准,用于考虑II类表位之间潜在的交叉反应。综上所述,我们在这里确定了140多个来自SARS-CoV-2基因组的人类T细胞表位。我们提供的直接证据表明,许多与SARS-CoV-2表位反应的CD4+T细胞实际上与多种不同的常见循环HCoV中的任何一个的相应同源序列发生交叉反应,并且这些反应细胞基本上是规范的记忆CD4+T细胞。这些交叉反应性HCoV T细胞特异性的发现与HCoV中和抗体形成鲜明对比,HCoV中和抗体是HCoV物种特异性的,与SARS-CoV-2RBD(33-35)没有交叉反应。基于这些数据,可以合理地假设,一些捐赠者先前存在的交叉反应HCoVCD4+T细胞记忆可能是导致新冠肺炎患者疾病预后变化的一个因素,但目前这一假设是高度推测的(36)。
Https://creativecommons.org/licenses/by/4.0/这是一篇开放获取的文章,根据知识共享署名许可证的条款分发,该许可证允许在任何介质上不受限制地使用、分发和复制,只要正确引用了原始作品。
致谢:我们要感谢拉霍亚免疫学研究所的流式细胞术核心设施在FACS实验期间提供的技术援助。资助:这项工作由NIH NIAID提供资金,奖励为AI42742(人类免疫学合作中心)(S.C.和A.S.)、国家卫生研究院合同编号75N9301900065(A.S.和D.W.)和U19AI118626(A.S.和B.P.)。这项工作还得到了NIAID根据K08奖项AI135078(J.D.)、UCSD T32s AI007036和AI007384传染病部门(S.Ram.,S.Raw.)的支持。和杜琪峰基金会(D.S)。作者投稿:概念化:D.W.,S.C.和A.S.;调查,J.M.A.G.,A.T,J.S.,E.P.。
.